УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10
КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИКЗАДАЧНИКЛАБОРАТОРНЫЙ ПРАКТИКУМНАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42/2003
Поэтому, против общего мнения, гидратация не должна пить восемь стаканов воды в день. Мы можем выпить десять, пятнадцать или даже двадцать стаканов воды в день, и у нас все равно не будет надлежащего увлажнения. Если мы не сможем держать воду в клетках, она будет проходить через тело, а не оставаться в клетках и увлажнять их. Отсутствие гидратации вызывает повреждение клеточной мембраны, точно так же, как пробитый карман, пытающийся удерживать монеты. Вода стекает из клеток, где она должна стоять и становится сточными водами.
Он содержит много отрицательных ионов водорода, которые захватываются клеточным кислородом, образующим метаболическую воду в клеточном энергогенерирующем процессе клеточного дыхания. Размер молекулы кластерной воды измеряется в Гц. Чем больше воды, тем меньше воды, тем легче организму ее поглощать!
§ 6.3. Сильные и слабые электролиты
Материал этого раздела частично вам знаком по ранее изученным школьным курсам химии и из предыдущего раздела. Кратко повторим, что вам известно, и познакомимся с новым материалом.
В предыдущем разделе мы обсуждали поведение в
водных растворах некоторых солей и органических
веществ, полностью распадающихся на ионы в
водном растворе.
Имеется ряд простых, но несомненных
доказательств того, что некоторые вещества в
водных растворах распадаются на частицы. Так,
водные растворы серной H 2 SO 4 , азотной HNO 3 ,
хлорной HClO 4 , хлороводородной (соляной) HCl,
уксусной CH 3 COOH и других кислот имеют кислый
вкус. В формулах кислот общей частицей является
атом водорода, и можно предположить, что он (в
виде иона) является причиной одинакового вкуса
всех этих столь различных веществ.
Образующиеся при диссоциации в водном растворе
ионы водорода придают раствору кислый вкус,
поэтому такие вещества и названы кислотами. В
природе только ионы водорода имеют кислый вкус.
Они создают в водном растворе так называемую
кислотную (кислую) среду.
Кандиновая ионизированная щелочная вода содержит избыток кислорода
Телу нужны обе формы кислорода. Это занимает около 3 минут. Люди с высокой щелочностью, такие как младенцы, могут жить дольше 3 минут. Хотя стало привычкой рассматривать наше сердце как действующее отдельно от мозга, оба они неразрывно связаны. Кислотно-щелочной характер - соотношение между ионами водорода и гидроксильными ионами в почвенном растворе, образованном процессами гидролиза и диссоциации с участием органических, минеральных или органо-минеральных соединений.
Запомните, когда вы говорите «хлороводород», то имеете в виду газообразное и кристаллическое состояние этого вещества, но для водного раствора следует говорить «раствор хлороводорода», «хлороводородная кислота» или использовать общепринятое название «соляная кислота», хотя состав вещества в любом состоянии выражается одной и той же формулой – НСl.
Более кислотная почва = чем меньше количество остатков оснований. Минеральные кислоты - не находятся в свободном состоянии почвенного раствора, а только в диссоциированной форме. Соли, которые гидролизуют кислоту, но накопленные количества довольно малы.
Фулвокислоты присутствуют в больших количествах в почвенном растворе. Соли, образованные со слабыми кислотами с сильными основаниями, выделяют сильные основания путем гидролиза. Адсорбент натрия и т.д. Соли, состоящие из сильных кислот и сильных оснований, не гидролизуются и, таким образом, не влияют на реакцию почвы.
Водные растворы гидроксидов лития (LiOH), натрия
(NаОН), калия (КОН), бария (Ва(ОН) 2), кальция
(Са(ОН) 2) и других металлов имеют одинаковый
неприятный горько-мыльный вкус и вызывают на
коже рук ощущение скольжения. По-видимому, за это
свойство ответственны гидроксид-ионы ОН – ,
входящие в состав таких соединений.
Хлороводородная HCl, бромоводородная HBr и
йодоводородная HI кислоты реагируют с цинком
одинаково, несмотря на свой различный состав, т.
к. в действительности с цинком реагирует не
кислота:
Zn + 2НСl = ZnСl 2 + Н2,
а ионы водорода:
Zn + 2H + = Zn 2+ + Н 2 ,
и образуются газообразный водород и ионы цинка.
Смешивание некоторых растворов солей, например
хлорида калия KCl и нитрата натрия NaNO 3 , не
сопровождается заметным тепловым эффектом, хотя
после выпаривания раствора образуется смесь
кристаллов четырех веществ: исходных – хлорида
калия и нитрата натрия – и новых – нитрата калия
КNO 3 и хлорида натрия NaCl. Можно предположить,
что в растворе две исходные соли полностью
распадаются на ионы, которые при его выпаривании
образуют четыре кристаллических вещества:
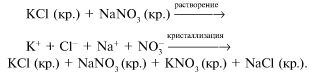
Сопоставляя эти сведения с
электропроводностью водных растворов кислот,
гидроксидов и солей и с рядом других положений,
С.А.Аррениус в 1887 г. выдвинул гипотезу
электролитической диссоциации, согласно которой
молекулы кислот, гидроксидов и солей при
растворении их в воде диссоциируют на ионы.
Изучение продуктов электролиза позволяет
приписать ионам положительные или отрицательные
заряды. Очевидно, если кислота, например азотная
НNO 3 , диссоциирует, предположим, на два иона
и при электролизе водного раствора на катоде
(отрицательно заряженный электрод) выделяется
водород, то, следовательно, в растворе имеются
положительно заряженные ионы водорода Н + .
Тогда уравнение диссоциации следует записать
так:
НNO 3 = Н + + .
Электролитическая диссоциация
–
полный или частичный распад соединения при его
растворении в воде на ионы в результате
взаимодействия с молекулой воды (или другого
растворителя).
Электролиты
– кислоты, основания или
соли, водные растворы которых проводят
электрический ток в результате диссоциации.
Вещества, не диссоциирующие в водном растворе на
ионы и растворы которых не проводят
электрический ток, называются неэлектролитами
.
Диссоциация электролитов количественно
характеризуется степенью диссоциации
– отношением числа распавшихся на ионы
«молекул» (формульных единиц) к общему числу
«молекул» растворенного вещества. Степень
диссоциации обозначается греческой буквой . Например, если из
каждых 100 «молекул» растворенного вещества 80
распадаются на ионы, то степень диссоциации
растворенного вещества равна: = 80/100 = 0,8, или 80%.
По способности к диссоциации (или, как говорят,
«по силе») электролиты разделяют на сильные
,
средние
и слабые
. По степени
диссоциации к сильным электролитам относят те из
них, для растворов которых > 30%, к слабым – < 3%, к средним – 3% 30%. Сила электролита –
величина, зависящая от концентрации вещества,
температуры, природы растворителя и др.
В случае водных растворов
к сильным электролитам
( > 30%) относят
перечисленные ниже группы соединений.
1
. Многие неорганические кислоты,
например хлороводородная НCl, азотная HNO 3 ,
серная H 2 SО 4 в разбавленных растворах.
Самая сильная неорганическая кислота – хлорная
НСlО 4 .
Сила некислородных кислот возрастает в ряду
однотипных соединений при переходе вниз по
подгруппе кислотообразующих элементов:
HCl – HBr – HI.
Фтороводородная (плавиковая) кислота HF растворяет стекло, но это вовсе не говорит о ее силе. Эта кислота из бескислородных галогенсодержащих относится к кислотам средней силы из-за высокой энергии связи Н–F, способности молекул HF к объединению (ассоциации) благодаря сильным водородным связям, взаимодействия ионов F – с молекулами НF (водородные связи) с образованием ионов и других более сложных частиц. В результате концентрация ионов водорода в водном растворе этой кислоты оказывается значительно пониженной, поэтому фтороводородную кислоту считают средней силы.
Фтороводород реагирует с диоксидом кремния, входящим в состав стекла, по уравнению:SiO 2 + 4HF = SiF 4 + 2H 2 O.
Фтороводородную кислоту нельзя хранить в стеклянных сосудах. Для этого используют сосуды из свинца, некоторых пластмасс и стекла, стенки которых покрыты изнутри толстым слоем парафина. Если для «травления» стекла использовать газообразный фтороводород, то поверхность стекла становится матовой, что используется для нанесения на стекло надписей и различных рисунков. «Травление» стекла водным раствором фтороводородной кислоты приводит к разъеданию поверхности стекла, которая остается прозрачной. В продаже обычно бывает 40%-й раствор плавиковой кислоты.
Сила однотипных кислородных кислот изменяется
в противоположном направлении, например йодная
кислота НIО 4 слабее хлорной кислоты НСlО 4 .
Если элемент образует несколько кислородных
кислот, то наибольшей силой обладает кислота, в
которой кислотообразующий элемент имеет самую
высокую валентность. Так, в ряду кислот НСlО
(хлорноватистая) – НСlО 2 (хлористая) – НСlО 3
(хлорноватая) – НСlО 4 (хлорная) последняя
наиболее сильная.
Один объем воды растворяет около двух объемов хлора. Хлор (примерно половина его) взаимодействует с водой:
Cl 2 + H 2 O = HCl + HСlO.
Хлороводородная кислота является сильной, в ее водном растворе практически нет молекул HCl. Правильнее уравнение реакции записать так:
Cl 2 + H 2 O = H + + Cl – + HClO – 25 кДж/моль.
Образующийся раствор называют хлорной водой.
Хлорноватистая кислота – быстродействующий окислитель, поэтому ее применяют для отбеливания тканей.
2 . Гидроксиды элементов главных подгрупп I и II групп периодической системы: LiОН, NaОН, КОН, Са(ОН) 2 и др. При переходе вниз по подгруппе по мере усиления металлических свойств элемента сила гидроксидов возрастает. Растворимые гидроксиды главной подгруппы I группы элементов относят к щелочам.
Щелочами называют растворимые в воде основания. К ним относят также гидроксиды элементов главной подгруппы II группы (щелочно-земельные металлы) и гидроксид аммония (водный раствор аммиака). Иногда щелочами считают те гидроксиды, которые в водном растворе создают высокую концентрацию гидроксид-ионов. В устаревшей литературе вы можете встретить в числе щелочей карбонаты калия К 2 СО 3 (поташ) и натрия Na 2 CO 3 (сода), гидрокарбонат натрия NaHCO 3 (питьевая сода), буру Na 2 B 4 O 7 , гидросульфиды натрия NaHS и калия KHS и др.
Гидроксид кальция Са(ОН) 2 как сильный электролит диссоциирует в одну ступень:
Са(ОН) 2 = Са 2+ + 2ОН – .
3 . Почти все соли. Соль, если это сильный электролит, диссоциирует в одну ступень, например хлорид железа:
FeCl 3 = Fe 3+ + 3Cl – .
В случае водных растворов к слабым электролитам ( < 3%) относят перечисленные ниже соединения.
1 . Вода H 2 O – важнейший электролит.
2
. Некоторые неорганические и почти
все органические кислоты: H 2 S
(сероводородная), H 2 SO 3 (сернистая), H 2 CO 3
(угольная), HCN (циановодородная), Н 3 РО 4
(фосфорная, ортофосфорная), H 2 SiO 3
(кремниевая), H 3 BO 3 (борная, ортоборная),
СН 3 СООН (уксусная) и др.
Заметим, что угольная кислота в формуле H 2 CO 3
не существует. При растворении углекислого газа
СО 2 в воде образуется его гидрат СО 2 Н 2 О,
который мы для удобства расчетов записываем
формулой H 2 CO 3 , и уравнение реакции
диссоциации выглядит так:
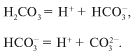
Диссоциация слабой угольной кислоты проходит в
две ступени. Образующийся гидрокарбонат-ион также ведет себя
как слабый электролит.
Точно так же ступенчато диссоциируют и другие
многоосновные кислоты: Н 3 РО 4
(фосфорная), H 2 SiO 3 (кремниевая), H 3 BO 3
(борная). В водном растворе диссоциация
практически проходит лишь по первой ступени. Как
осуществить диссоциацию по последней ступени?
3
. Гидроксиды многих элементов, например
Аl(OH) 3 , Cu(OH) 2 , Fe(OH) 2 , Fe(OH) 3 и др.
Все эти гидроксиды диссоциируют в водном
растворе ступенчато, например гидроксид железа
Fe(OH) 3:
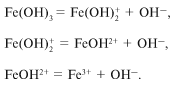
В водном растворе диссоциация проходит
практически только по первой ступени. Как
сместить равновесие в сторону образования ионов
Fe 3+ ?
Осно"вные свойства гидроксидов одного и того же
элемента усиливаются с уменьшением валентности
элемента. Так, осно"вные свойства дигидроксида
железа Fe(OH) 2 выражены сильнее, чем у
тригидроксида Fe(OH) 3 . Это утверждение
равносильно тому, что кислотные свойства Fe(OH) 3
проявляются сильнее, чем у Fe(OH) 2 .
4
. Гидроксид аммония NH 4 OH.
При растворении газообразного аммиака NH 3 в
воде получается раствор, который очень слабо
проводит электрический ток и имеет
горько-мыльный вкус. Среда раствора осно"вная,
или щелочная. Объясняется такое поведение
аммиака следующим образом. При растворении
аммиака в воде образуется гидрат аммиака NH 3 Н 2 О,
которому условно мы приписываем формулу
несуществующего гидроксида аммония NH 4 OH,
считая, что это соединение диссоциирует с
образованием иона аммония и гидроксид-иона ОН – :
NH 4 OH = + ОН – .
5 . Некоторые соли: хлорид цинка ZnCl 2 , тиоцианат железа Fe(NСS) 3 , цианид ртути Hg(CN) 2 и др. Эти соли диссоциируют ступенчато.
К электролитам средней силы некоторые относят фосфорную кислоту Н 3 РО 4 . Мы будем считать фосфорную кислоту слабым электролитом и записывать три ступени ее диссоциации. Серная кислота в концентрированных растворах ведет себя как электролит средней силы, а в очень концентрированных растворах – как слабый электролит. Мы далее будем считать серную кислоту сильным электролитом и записывать уравнение ее диссоциации в одну ступень.
Электролитическая диссоциация гидроксидов и солей
В водных растворах гидроксиды и соли проводят электрический ток в результате распада на заряженные частицы – ионы. Этот процесс носит название электролитическая диссоциация , а вещества, распадающиеся на ионы в водном растворе, называются электролитами.
Кислотами с точки зрения теории электролитической диссоциации называют вещества , распадающиеся в водных растворах на положительно заряженные ионы водорода (Н +) и отрицательно заряженные ионы кислотного остатка . Например, соляная кислота диссоциирует по уравнению
HCl↔H + + Cl - .
Положительно заряженные ионы называют катионами, а отрицательно заряженные – анионами. Таким образом, при диссоциации соляной кислоты образуется катион водорода и анион хлора (хлорид-ион ).
Число ионов водорода, образующихся при полной диссоциации молекулы кислоты, называется основностью кислоты .Так, соляная кислота является одноосновной , а серная кислота – двухосновной , т.к. при её диссоциации образуются два иона водорода:
Электролиты могут диссоциировать (распадаться на ионы) полностью, и такие вещества называют сильными электролитами. Электролиты, диссоциирующие частично, называют слабыми или средними. Серная, азотная и соляная кислоты относятся к сильным электролитам (сильным кислотам), а угольная кислота является слабой кислотой (слабым электролитом).
Основаниями с точки зрения теории электролитической диссоциации называют вещества, распадающиеся в водных растворах на положительно заряженные ионы металла и отрицательно заряженные гидроксид-ионы (ОН -) . Например, гидроксид натрия диссоциирует по уравнению
NaOH↔Na + + OH - .
Число гидроксид-ионов, образующихся при полной диссоциации молекулы основания, называется кислотностью основания. Так, гидроксид натрия является однокислотным , а гидроксид кальция – двухкислотным :
Ca(OH) 2 ↔ Ca 2+ + 2OH - .
Основания, как и все электролиты, могут быть сильными, слабыми и средней силы. Гидроксиды натрия, калия и кальция являются сильными основаниями, а гидроксид аммония – слабым основанием.
Амфотерные гидроксиды могут диссоциировать как кислоты и как основания:
Zn(OH) 2 ↔ Zn 2+ + 2OH - ;
Zn(OH) 2 ↔ 2H + + ZnO 2 2- .
В реакциях с кислотами амфотерные гидроксиды диссоциируют как основания, а в реакциях с основаниями – как кислоты.
Средние соли в водных растворах диссоциируют на катионы металла и анионы кислотного остатка:
Кислые соли могут диссоциировать частично:
или полностью с образованием кроме иона металла также катиона водорода:
Соответственно, основные соли также могут диссоциировать частично или полностью:
CaOHCl ↔ CaOH + + + Cl - ;
CaOHCl ↔ Ca 2+ + OH - + Cl - .
Большинство солей являются сильными электролитами.
1.11. Контрольные вопросы
1. Какие элементы 3-го периода ПСЭМ относятся к металлам? Ответ: натрий, магний, алюминий.
2. Какие элементы 4-й группы главной подгруппы относятся к неметаллам, полуметаллам, металлам?
Ответ: углерод, кремний – неметаллы, германий – полуметалл, олово и свинец – металлы.
3. Напишите уравнения реакций взаимодействия цинка (СО + 2), фосфора (СО + 5) и титана (СО + 4) с кислородом.
4. Напишите уравнения реакций взаимодействия кальция, фосфора (СО +3, и калия с хлором.
5. Напишите уравнения реакции взаимодействия оксида фосфора(V) и оксида магния с водой.
6. Напишите уравнение реакции взаимодействия оксида магния с оксидом углерода (IV).
7. Напишите уравнения реакций взаимодействия оксида алюминия с оксидом натрия и оксидом серы (VI).
8. Напишите уравнение реакции взаимодействия соляной кислоты с алюминием.
9. Напишите уравнение реакции взаимодействия азотной кислоты с оксидом алюминия.
10. Напишите уравнения реакций взаимодействия серной кислоты с гидроксидом калия и гидроксидом железа (II).
11. Напишите уравнение реакции взаимодействия гидроксида аммония с соляной кислотой.
12. Напишите уравнения реакций взаимодействия гидроксида натрия с оксидом серы (VI) и оксидом цинка (степень окисления цинка +2).
13. Напишите уравнение реакции взаимодействия сульфата железа (III) с едким натром, зная, что гидроксид железа (III) не растворим в воде.
14. Напишите уравнение реакции взаимодействия соляной кислоты с сульфитом натрия (Na 2 SO 3), зная, что сернистая кислота неустойчива и разлагается на воду и газообразный оксид серы (IV).
15. Напишите уравнение реакции взаимодействия сульфата натрия с хлоридом кальция, зная, что сульфат кальция не растворим в воде.
16. Напишите уравнения электролитической диссоциации азотной кислоты, гидроксида калия и хлорида магния.
17. Напишите уравнения электролитической диссоциации угольной кислоты, гидроксида магния и сульфата алюминия.
18. Напишите уравнения электролитической диссоциации фосфорной кислоты (H 3 PO 4) , гидроксида бария (Ba(OH) 2) и нитрата магния.


