Предельные одноатомные спирты (алканолы) содержат одну гидроксильную группу –ОН, соединённую с насыщенным углеводородным радикалом. Общая формула алканолов: С n H 2 n +1 OH
Гидроксильная группа – ОН является функциональной группой спиртов. Функциональными группами называются группы атомов, которые обусловливают характерные химические свойства данного класса веществ.
Физические свойства спиртов
Группа может быть первичной, вторичной или третичной. Алкоголь может быть открытой цепью или циклической. Он также может содержать двойную связь, атом галогена или ароматическое кольцо. Спирты как производные воды Наиболее известным ковалентным соединением является вода. Замена одного из атомов водорода в молекуле воды алкильной группой приводит к образованию спирта. Нижние являются жидкостями и растворимы в воде. Наличие метильной группы вместо водорода в метанольном счетчике приводит к сжатию угла связи, вызванному отталкиванием одиночной пары-одиночной пары в кислороде.
Гомологический ряд алканолов : CH 3 OH метанол, метиловый спирт
C 2 H 5 OH этанол, этиловый спирт
C 3 H 7 OH пропанол
C 4 H 9 OH бутанол
C 5 H 11 OH пентанол
Изомерия C 4 H 9 OH
CH 3 – CH 2 – CH 2 – CH 2 – OH бутанол-1
СН 3 -СН-СН 2 -ОН СН 3 -СН 2 -СН-СН 3
2-метилпропанол-1 2-бутанол
Физические свойства. Одноатомные предельные первичные спирты с короткой цепью углеродных атомов – жидкости, а высшие (начиная с С 12 Н 25 ОН) – твёрдые вещества. Метанол, этанол, пропанол – бесцветные жидкости, растворимы в воде, имеют спиртовой запах. Метанол – сильный яд. Все спирты ядовиты, обладают наркотическим действием.
Очевидная молекулярная масса воды в несколько раз больше из-за более сильной межмолекулярной водородной связи, и именно по этой причине вода имеет такую высокую температуру кипения по сравнению с соединениями с аналогичной молекулярной массой. Растворимость низших спиртов в воде также может быть связана с образованием водородных связей с водой. Как обсуждалось выше, одноатомные спирты содержат одну гидроксильную группу в их молекуле. Одноатомные спирты далее классифицируются как первичный, вторичный и третичный спирт в зависимости от того, присоединена ли гидроксильная группа к первичному, вторичному или третичному углеродному атому.
Химические свойства
1. Растворы спиртов имеют нейтральную реакцию на индикаторы
2. Взаимодействие с щелочными металлами
2C 2 H 5 OH + 2Na → 2C 2 H 5 ONa + H 2
этанол этилат натрия
3. Взаимодействие с галогеноводородами
C 2 H 5 OH + HCl →C 2 H 5 Cl + H 2 O
хлорэтан
4. Дегидратация (при t и в присутствии H 2 SO 4)
Они содержат молекулу трехвалентной группы. Существует три системы обозначения спиртов. Общая система. В соответствии с этим наименования нижних элементов получают путем добавления слова «алкоголь» после названия алкильной группы, присутствующей в молекуле, например. В соответствии с этим спирты считаются производными из метилового спирта замещением одного или нескольких атомов водорода другими 3-алкильными группами. Гидроксильная группа имеет приоритет над двойными и тройными связями. Все заместители назначают их числа, как в случае алкан или алкен.
C 2 H 5 OH → C 2 H 4 + H 2 O
2 C 2 H 5 OH→ C 2 H 5 –О- C 2 H 5
диэтиловый эфир
5. Горение
C 2 H 5 OH + 3O 2 → 2CO 2 + 3H 2 O +Q
6. Окисление
C 2 H 5 OH + CuO → Cu + H 2 O + CH 3 -CHO
этанол уксусный альдегид
7. Взаимодействие с карбоновыми кислотами (реакция этерификации)
C 2 H 5 OH + CH 3 COOH → CH 3 COOC 2 H 5 + H 2 O
Получение этанола:
Этанол получают из
Высшие алифатические спирты проявляют два типа изомерии: цепную изомерию. Одноатомные спирты, содержащие хиральные центры, обладают оптической изомерией и, таким образом, существуют в виде пары энантиомеров, например. Все три типа спиртов, то есть первичные, вторичные и третичные спирты, могут быть получены с помощью реагента Гриньяра путем его взаимодействия с соответствующим альдегидом или кетоном. Реакция Гриньяра 5 является важной реакцией и используется для образования новой углерод-углеродной связи.
Обычно реагент Гриньяра не изолирован и готов на месте путем взаимодействия чистого и сухого магниевого металла с алкилом или арилгалогенидом в сухом эфире. Затем альдегид или кетон добавляют к его эфирному раствору. Образующийся продукт присоединения гидролизуется обработкой реакционной смеси разбавленной кислотой или раствором хлорида аммония. Их получают обработкой реактива Гриньяра оксидом этилена с формальдегидом, пропускающим сухой кислород или этиленхлоргидрин с последующим гидролизом продукта присоединения.
1) этилена: C 2 H 4 + HOH → C 2 H 5 OH (при катализаторе и t)
2) брожением глюкозы: C 6 H 12 O 6 → 2C 2 H 5 OH + 2CO 2
Применение этанола : получение уксусной кислоты, лекарств, духов и одеколонов, каучуков, горючего для двигателей, красителей, лаков, растворителей и других веществ.
12. Глицерин – представитель многоатомных спиртов. Строение, физические и химические свойства (реакция этерификации), применение.
Их получают обработкой реактива Гриньяра альдегидами, отличными от формальдегида или одной молекулы этилформиата, с последующим гидролизом продукта присоединения. Альдегиды и кетоны могут быть восстановлены до первичных и вторичных спиртов соответственно либо путем каталитического гидрирования, либо с использованием химических восстановителей, таких как натрий и этанол, литийалюминийгидрид в эфирном растворе. Этим способом не могут быть получены третичные спирты. 9 Каталитическое гидрирование. Каталитическая активность данного металла зависит от способа его получения, наличия промоторов или ингибиторов и природы растворителя.
Глицерин – трёхатомный спирт:
Глицерин – бесцветная сиропообразная жидкость сладковатого вкуса, хорошо растворимая в воде, гигроскопичная. Глицерин получают расщеплением жиров.
Химические свойства.
1. Взаимодействие с щелочными металлами
СН 2 ОН CH 2 ONa
СНОН + 2Na → CHONa + H 2
СН 2 ОН CH 2 OH
2. Взаимодействие с галогеноводородами
Алкилгалогениды при гидролизе водными щелочами или влажным оксидом серебра дают спирты. Как правило, алкилгалогениды получают из спиртов, поскольку последние легко доступны. Это реакция нуклеофильного замещения, в которой ионы гидроксида заменяют ионы галогенида. Среди алкилгалогенидов алкил-иодиды подвергаются нуклеофильному замещению с наименьшей скоростью. Вторичные алкилгалогениды могут следовать за любым из механизмов в зависимости от используемого реагента. Выбор растворителя позволяет контролировать: водный 12 раствор способствует замещению, в то время как алкогольный раствор способствует устранению.
СН 2 ОН CH 2 Cl
СНОН +3HCl → CH Cl + 3H 2 O
СН 2 ОН CH 2 Cl
3. Реакция этерификации (нитрование-взаимодействие с азотной кислотой)
4. Качественная реакция на многоатомный спирт
СН 2 ОН CH 2 O
СНОН + Cu(OH) 2 → CHO - Cu +H 2 O
СН 2 ОН CH 2 OH
Образуется синий раствор глицерата меди.
Применение глицерина – в медицине – для смягчения кожи и приготовлении мазей, в кожевенном производстве – для предохранения кож от высыхания, для получения пластмасс и взрывчатых веществ (нитроглицерин).
Третичные алкилгалогениды и, в меньшей степени, вторичные алкилгалогениды, склонны к дегидрогалогенированию и получают алкен, даже когда используют водный раствор. Для этих галогенидов лучше всего использовать простой гидролиз с водой, хотя даже здесь получается значительный алкен. Из эфиров. Кислотным или щелочным гидролизом. Гидролизом с использованием горячей разбавленной серной кислоты под давлением, например, разбавленной. Путем восстановления с помощью следующих реагентов: натрий и спирт. Водород и металлический катализатор.
Литийалюминийгидрид в эфирном растворе. Восстановление сложного эфира каталитическим методом требует более тяжелых условий. Необходимы высокие давления и повышенные температуры. Первичные амины при обработке азотистой кислотой дают спирты. Алкен добавляют при комнатной температуре к водному раствору ацетата ртути, разбавленного растворителем тетрагидрофураном. Реакция обычно завершается в течение нескольких минут. Органо-ртутное соединение затем немедленно восстанавливают боргидридом натрия в демеркурации.
Спиртами называются производные углеводородов, содержащие одну или несколько групп -ОН, называемую гидроксильной группой или гидроксилом.
Спирты классифицируют:
1. По числу гидроксильных групп, содержащихся в молекуле, спирты делятся на одноатомные (с одним гидроксилом), двухатомные (с двумя гидроксилами), трехатомные (с тремя гидроксилами) и многоатомные.
Последовательность реакции представляет собой гидратацию алкена, следуя правилу Марканикова. Было высказано предположение, что образуется циклический ион ртути. При гидроборировании-окислении алкенов. Реакция не является одной стадией, а протекает в последовательности, в которой каждый атом водорода борана замещен алкильной группой. Окисление проводят с помощью щелочной перекиси водорода. Этим методом может быть получен только первичный и вторичный спирт. Перестановки не происходят при гидроборировании, поскольку в качестве промежуточных продуктов не образуются ионы карбония.
Подобно предельным углеводородам, одноатомные спирты образуют закономерно построенный ряд гомологов:
Как и в других гомологических рядах, каждый член ряда спиртов отличается по составу от предыдущего и последующего членов на гомологическую разность (-СН 2 -).
2.
В зависимости от того, при каком атоме
углерода находится гидроксил,
различают первичные, вторичные и
третичные спирты. В молекулах первичных
спиртов содержится группа -СН 2 ОН,
связанная с одним радикалом или с атомом
водорода у метанола (гидроксил при
первичном атоме углерода). Для вторичных
спиртов характерна группа >СНОН,
связанная с двумя радикалами (гидроксил
при вторичном атоме углерода). В молекулах
третичных спиртов имеется группа
>С-ОН, связанная с тремя радикалами
(гидроксил при третичном атоме углерода).
Обозначая радикал через R,
можно написать формулы этих спиртов
в общем виде: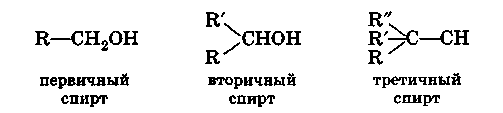
В обычных реакциях электрофильного присоединения при двойной связи нуклеофильная часть реагента присоединяется к тому атому углерода, который присоединен к наименьшему числу атомов водорода. При этом наилучшая возможная привязка такова, что положительный заряд может образовываться на углероде, который может комфортно его разместить. Таким образом, когда переходное состояние приближается, как атом углерода, так и электронно-дефицитный атом бора становятся кислыми. Поскольку бор имеет атом водорода, связанный с ним парой электронов, поэтому электронно-дефицитный углерод поглощает этот водород, и бор теряет его за счет полученных π-электронов.
В соответствии с номенклатурой ИЮПАК при построении названия одноатомного спирта к названию родоначального углеводорода добавляется суффикс -ол. При наличии в соединении более старших функций гидроксильная группа обозначается префиксом гидрокси- (в русском языке часто используется префикс окси-). В качестве основной цепи выбирается наиболее длинная неразветвленная цепь углеродных атомов, в состав которой входит атом углерода, связанный с гидроксильной группой; если соединение является ненасыщенным, то в эту цепь включается также и кратная связь. Следует заметить, что при определении начала нумерации гидроксильная функция обычно имеет преимущество перед галогеном, двойной связью и алкилом, следовательно, нумерацию начинают с того конца цепи, ближе к которому расположена гидроксильная группа:
Таким образом, реакции связаны с одной стадией только с одним переходным состоянием, в котором водород и бор добавляют к углеродной углеродной двойной связи. Это, следовательно, четыре центра переходного состояния. Оксо-процесс. Катализатор состоит из кобальта, тории, кизельгура. Определенные углеводы при ферментации дают спирты под воздействием подходящих ферментов в анаэробных условиях. Физические свойства. Нижние элементы представляют собой бесцветные летучие жидкости, имеющие характерный алкогольный запах и жгучий вкус.
Более высокий член - бесцветные твердые вещества. Первые три элемента полностью смешиваются с водой из-за их склонности образовывать водородную связь с молекулами воды. Растворимость быстро уменьшается с увеличением числа атомов углерода. Более высокие члены практически нерастворимы в воде. Удельный вес и точки кипения возрастают с увеличением молекулярного веса. Первичный спирт имеет более высокую температуру кипения, чем соответствующий вторичный спирт, а последний имеет более высокую температуру кипения, чем соответствующий третичный спирт.
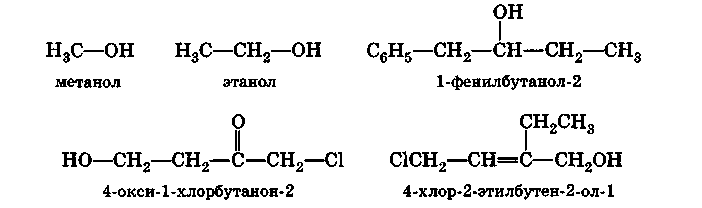
Простейшие спирты называют по радикалам, с которыми соединена гидроксильная группа: (СН 3) 2 СНОН - изопропиловый спирт, (СН 3) 3 СОН - трет-бутиловый спирт.
Часто употребляется рациональная номенклатура спиртов. Согласно этой номенклатуре, спирты рассматриваются как производные метилового спирта - карбинола:
Ассоциация среди спиртов. Известно, что всякий раз, когда водород ковалентно связан с сильно электроотрицательным атомом, таким как кислород в спиртах, общая пара электронов частично смещается в сторону атома кислорода. В жидком этаноле положительный и отрицательный концы этих диполей выстраиваются для получения аддитивных взаимодействий. Структура углеродной цепи также играет свою роль, например, н-бутанол достаточно растворим в воде, но трет-бутанол смешивается с водой во всех пропорциях. Циклогексиловый спирт является более растворимым, чем н-гексиловый спирт, благодаря своей компактной гидрофобной цепи.
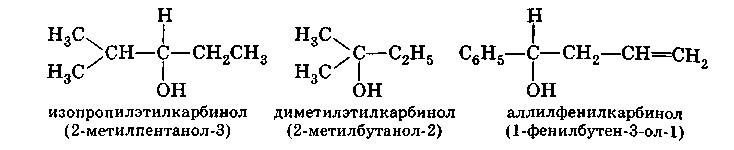
Эта система удобна в тех случаях, когда название радикала является простым и легко конструируемым.
2. Физические свойства спиртов
Спирты имеют более высокие температуры кипения и значительно менее летучи, имеют более высокие температуры плавления и лучше растворимы в воде, чем соответствующие углеводороды; однако различие уменьшается с ростом молекулярной массы.
Растворимость в воде. Смешивающийся. Смешиваемый н-пропил. Смешиваемый трет-бутил. Смешанный изо-бутил. 0% н-бутил. 1%. Циклогексил. 6% н-гексил. 6%. Гексан-1, 6-диол. Реакции, связанные с расщеплением ОН-связки: Некоторые примеры таковы: Ацидная природа спиртов Спирты могут быть кислыми по своей природе, поскольку атом водорода присоединен к сильно электроотрицательному атому кислорода и может быть удален как протон. Это можно сделать, используя сильное основание, чем образовавшийся алкоксид. В результате каждый атом кислорода имеет разную плотность электронов.
Разница в физических свойствах связана с высокой полярностью гидроксильной группы, которая приводит к ассоциации молекул спирта за счет водородной связи:

Таким образом, более высокие температуры кипения спиртов по сравнению с температурами кипения соответствующих углеводородов обусловлены необходимостью разрыва водородных связей при переходе молекул в газовую фазу, для чего требуется дополнительная энергия. С другой стороны, такого типа ассоциация приводит как бы к увеличению молекулярной массы, что естественно, обусловливает уменьшение летучести.
Таким образом, в сильных кислотах они существуют как ионы алкилоксония, в нейтральных средах в виде спиртов и в сильных основаниях в виде алкоксидов. Спирты можно назвать амфотерными. Амфотерная природа гидроксильной функциональной группы характеризует химическую реакционную способность спиртов. Спирты реагируют с кислотами с образованием сложных эфиров. Этот процесс называется этерификацией. Реакцию проводят в присутствии дегидратирующего агента, такого как концентрированная серная кислота или сухой хлористый водород.
Этерификация является обратимой реакцией, и поэтому вода удаляется, как только она образуется, чтобы предотвратить реакцию от движения в обратном направлении. Реакция является примером реакции нуклеофильного замещения по отношению к кислоте. На первой стадии образуется алкилсульфат водорода, который в разных условиях образует различные продукты. Процесс называется ацилированием. Спирты реагируют с реагентами Гриньяра, образуя алканы. В этом случае атом водорода гидроксильной группы объединяется с алкильной группой реактива Гриньяра, образующей алкан.
Спирты с низкой молекулярной массой хорошо растворимы в воде, это понятно, если учесть возможность образования водородных связей с молекулами воды (сама вода ассоциирована в очень большой степени). В метиловом спирте гидроксильная группа составляет почти половину массы молекулы; неудивительно поэтому, что метанол смешивается с водой во всех отношениях. По мере увеличения размера углеводородной цепи в спирте влияние гидроксильной группы на свойства спиртов уменьшается, соответственно понижается растворимость веществ в воде и увеличивается их растворимость в углеводородах. Физические свойства одноатомных спиртов с высокой молекулярной массой оказываются уже очень сходными со свойствами соответствующих углеводородов.
Спирты легко реагируют с галогенидами водорода с образованием алкилгалогенидов и воды. Реакцию проводят либо путем пропускания сухого газообразного галогенида водорода в спирт, либо путем нагревания спирта концентрированной водной галогеновой кислотой. Реакция является примером реакции нуклеофильного замещения, в которой галогенидный ион заменяет ион гидроксида. Фосфор пентахлорид дает алкилхлорид спиртами. Первичные спирты дегидратируют концентрированной серной кислотой при 170 ° С, а вторичные и третичные спирты кипятят разбавленной серной кислотой.



