Как гидроксида натрия, так и других щелочей, название «едкая щёлочь» обусловлено свойством разьедать кожу, бумагу, стекло и вызывать сильные ожоги. До XVII века, щёлочью (фр. alkali ) называли также карбонаты натрия и калия. В французский учёный А. Л. Дюамель дю Монсо впервые различил эти вещества: гидроксид натрия стали называть каустической содой, карбонат натрия - кальцинированной содой (по растению Salsola Soda, из золы которого её добывали), а карбонат калия - поташем . В настоящее время содой принято называть натриевые соли угольной кислоты. В английском и французском языках слово sodium означает натрий, potassium - калий.
Рынок каустической соды
В Чешской Республике она составляет не менее 30 млрд. Эксплуатационные расходы антикоррозийной системы снижают производительность из-за коррозии, потери эффективности, технического обслуживания и ремонта оборудования или системы антикоррозионной защиты.
Сопутствующие затраты на потерю продукции, снижение качества продукции, страхование, науку и исследования, ущерб окружающей среде и здоровью, рыночные потери. 8. Пятьдесят примеров желательной коррозии металлов. Производство и рафинирование. Электролитическое рафинирование меди, никеля и серебра, где основной металл является анодом. Металлическая цементация. Карбонильная очистка никеля. Цианирование в производстве серебра и золота.
Физические свойства
Гидроксид натрия
Термодинамика растворов
ΔH 0 растворения для бесконечно разбавленного водного раствора -44,45 кДж/моль.
Из водных растворов при 12,3 - 61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления 65,1 °C; плотность 1,829 г/см³; ΔH 0 обр −734,96 кДж/моль), в интервале от -28 до -24°С - гептагидрат, от -24 до -17,7°С - пентагидрат, от -17,7 до -5,4°С -тетрагидрат (α-модификация), от -5,4 до 12,3 °C. Растворимость в метаноле 23,6 г/л (t=28 °C), в этаноле 14,7 г/л (t=28 °C). NaOH·3,5Н 2 О (температура плавления 15,5 °C);
Извлечение банок из банок для рециклинга 9. Анодное окисление алюминия. Подготовка конверсионных покрытий. Происхождение патины Химическое окрашивание металлов. Подготовка поверхности для склеивания металлов. Травление разрезов в металлографии. 10. Окисление анодов при разряде в вторичных клетках. Растворение расходуемого анода при катодной защите от коррозии. Химическое производство Получение соединений чистого металла путем их окисления. Производство водорода в лаборатории путем растворения цинка.
Получение дубильной кислоты путем растворения цинка в соляной кислоте. 11. Тихий и простой таймер для террористов. Удаление маркерного ошейника для обнаружения животных в дикой природе после выгрузки батарей. Очистка воды, загрязненной ионами меди путем цементации на железном ломе. 12. Осветление кузовов автомобилей кислотным отбеливанием при изготовлении спец. Травление металлических пластин для печати, изготовление знаков. Сосредоточьтесь на тупых рашпилах в кислоте по старым рецептам. Дозировка латунного ингибитора при катодной защите путем растворения железных анодов.
Химические свойства
(в целом такую реакцию можно представить простым ионным уравнением, реакция протекает с выделением тепла (экзотермическая реакция): OH - + H 3 O + → 2H 2 O. )
- с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твердыми при сплавлении:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
Для злонамеренной коррозии соседнего автомобиля или орла 13. Коррозия газопроводов 18. Коррозионные информационные системы 27. Использование коррозии для художественных целей. Основой коррозии металлов в электролитах является электрохимическое превращение. 40. Металл находится в равновесии с его продуктами растворимой коррозии, единственным конкурирующим веществом является вода. неблагородные металлы драгоценные металлы 41. Экспресс-диаграммы. Невосприимчивость к пассивности.
Технологическая схема электролиза с твёрдым катодом
Золотой тантал. 47. Металл создает анион анодным окислением. Электролитные компоненты потребляют освобожденные электроны путем их собственного восстановления. Установлен потенциал самоходной коррозии, где скорость окисления металла равна скорости восстановления среды 50. Причиной спонтанной пассивации большинства технических металлов является окислительное действие среды на образование оксидного слоя.
так и с растворами:
ZnO + 2NaOH (раствор) + H 2 O → Na 2 (раствор) +H 2
(Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора - тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.)
- с кислотными оксидами - с образованием солей; это свойство используется для очистки промышленных выбросов от кислотных газов (например: CO 2 , SO 2 и H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu(OH) 2 ↓+ Na 2 SO 4
Лабораторные способы получения
Нарушения пассивности приводят к неравномерным формам коррозии 56. Пассивация - очень старая нанотехнология, на которой основана коррозионная стойкость большинства технических металлов. 57. Причиной спонтанной пассивации большинства технических металлов является окислительный эффект окружающей среды для образования оксидного слоя.
Нарушение пассивности приводит к неравномерным формам коррозии 58. Коррозия в активном или пассивном состоянии Неравномерная коррозия в активном состоянии. Коррозия в активном состоянии обычно не связана с неравномерными формами коррозии, что ограничивает использование металла. Важное значение имеет активация пассивного металла. 61.
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия , действуя гидроксидом натрия на сульфат алюминия в водном растворе. Его и используют, в частности, для очистки воды от мелких взвесей.
Макроэлементы приводят к неравномерному нападению. 63. Самым серьезным последствием является локальная активация первоначально пассивного металла. Объединив анодную коррозию, и катодная коррозия падает, анодная коррозия всегда выше анодной коррозии 66. Коррозия клетками. Коррозия из-за концентрации клеток чаще всего является клеткой с различной аэрацией. 70.
Первичная гетерогенность кислорода вызывает вторичные изменения состава коррозионной среды в условиях конвективной конвекции. Вблизи анода гидролиз уменьшается и концентрация хлорида увеличивается за счет миграции. Вблизи катода наблюдается увеличение рН за счет снижения содержания кислорода, а концентрация хлоридов уменьшается за счет миграции. Вторичные изменения в химическом составе приводят к активации анодной поверхности и катодной пассивации. Загрязненные растворы применяются для: коррозии с дифференциальной аэрацией, щелевой и точечной коррозией, средой, вызванной трещиной, селективной коррозией. 71.
Гидролиз эфиров
- с жирами (омыление), такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин . Глицерин впоследствии извлекается из подмыльных щёлоков путем вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века:

Типы коррозии Поверхностная коррозия Неравномерная коррозия 72. Коррозия коррозионной коррозией из-за биметаллических коррозионных клеток из-за концентрационных клеток чаще всего представляет собой изделие с различной аэрацией. Коррозия в прорези 76 также ускоряется путем изменения окружающей среды, что обусловлено действием статьи: растворение компонентов герметизирующего материала, концентрации или разбавления электролита, удержания электролита, повышенная температуры. 76.
Антикоррозионное покрытие 70% органическое 20% металл 10% другое 135. Антикоррозийная защита путем обработки окружающей среды Изменение физических условий Ингибирование дестимуляции 142. Требуемое снижение скорости коррозии железа в почвенном электролите составляет по меньшей мере один порядок, т.е. порядка 10-1 мм в год до менее 10-2 мм в год 145. Пояснение принципа катодной защиты вследствие катодной пассивации. 149. Первичная защита от коррозии - электрически непроводящее покрытие.
Процесс омыления жиров
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла, в зависимости от состава жира.
HO-CH 2 -CH 2 ОН + 2NaOH → NaO-CH 2 -CH 2 -ONa + 2Н 2 O
2NaCl + 2H 2 О = H 2 + Cl 2 + 2NaOH,В настоящее время едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них - электролиз с твёрдым асбестовым или полимерным катодом (диафрагменный и мембранный методы производства), третий - электролиз с жидким катодом (ртутный метод производства). В ряду электрохимических методов производства самым лёгким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Мембранный метод производства самый эффективный, наименее энергоёмкий и наиболее экологичный, но и самый капризный, в частности, требует сырьё более высокой чистоты.
Катодная защита является дополнительным антикоррозионным действием, которое действует в местах сломанного покрытия. 150. Коррозия железобетонных конструкций. Анатомированный анод для защиты морской воды. Антикоррозийная защита посредством структурных изменений.
Введение в коррозию Коррозия представляет собой процесс деградации металла или металлического сплава действием. Повторение с преподавания материала 1 Интерфейс поверхности двух сред Изменение силы скачка влияет на: поверхностный слой материала. Повреждение компонентов станка Деградация компонентов машины Процессы штрихов происходят в машинах, которые приводят к изменениям свойств компонентов. Эти изменения являются основными техническими причинами.
Едкие щёлочи, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом. Для некоторых производств это важно. Так, в производстве искусственных волокон можно применять только каустик, полученный при электролизе с жидким ртутным катодом. В мировой практике используются все три метода получения хлора и каустика, при явной тенденции в сторону увеличения доли мембранного электролиза. В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % - электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Коррозия металлов Коррозия лат. коррозия = коррозия 1 Коррозия металлов Коррозия металлов, пластмасс, силикатных материалов Принципы коррозионных процессов = коррозионная инженерия Машиностроение Механическая прочность Внешний вид Электротехника. Экспертом, назвавшим батарею, является гальваническая ячейка. Гальваническая ячейка - это устройство, которое использует окислительно-восстановительные реакции в качестве источника энергии.
Электрохимическая подготовка металлов и их сплавов Основные электрохимические методы Промышленное производство основных металлов - алюминия Основные электрохимические методы - Электролиз, фундаменты и принципы - Гальваника. Электрический ток в жидкостях Чистые жидкости, ограниченные водой, являются относительно хорошими изоляторами. Однако, когда соль, кислота или основание растворяются в воде, мы получаем так называемый электролит, который уже достаточно хорош.
Эффективность процесса производства рассчитывается не только по выходу едкого натра, но и по выходу хлора и водорода, получаемых при электролизе, соотношение хлора и гидроксида натрия на выходе 100/110, реакция протекает в следующих соотношениях:
1,8 NaCl + 0, 5 H 2 O + 2,8 МДж = 1,00 Cl 2 + 1,10 NaOH + 0,03 H 2 ,Основные показатели различных методов производства даны в таблице:
Коррозия с помощью макроэлементов Введение Для образования коррозионного элемента необходимо соединить два разных проводящих материала в коррозионной среде, по крайней мере один из которых представляет собой металл или два одинаковых металла в окружающей среде.
При окислении электрон высвобождается и его число окисления увеличивается. Гальванические элементы Большинство металлов, погруженных в воду или электролит. Определение коррозии Коррозия - это материал, вызывающий беспокойство из-за окружающей среды. Вторичные электрохимические ячейки менее известны как аккумуляторы, все электрохимические реакции являются обратимыми, решает проблему, решая экономически.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора % | 97 | 96 | 98,5 |
| Электроэнергия (кВт·ч) | 3 150 | 3 260 | 2 520 |
| Концентрация NaOH | 50 | 12 | 35 |
| Чистота хлора | 99,2 | 98 | 99,3 |
| Чистота водорода | 99,9 | 99,9 | 99,9 |
| Массовая доля O 2 в хлоре, % | 0,1 | 1-2 | 0,3 |
| Массовая доля Cl - в NaOH, % | 0,003 | 1-1,2 | 0,005 |
Технологическая схема электролиза с твёрдым катодом
Диафрагменный метод - Полость электролизёра с твёрдым катодом разделена пористой перегородкой - диафрагмой - на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения - диафрагменным электролизом . В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита. В результате электрохимического процесса на аноде за счет разложения галита выделяется хлор, а на катоде за счет разложения воды - водород. Хлор и водород выводятся из электролизёра раздельно, не смешиваясь:
Лабораторная работа № 8: Электрохимические методы определения степени коррозии Цель работы: Цель лабораторной задачи. Электрохимические методы определения скорости коррозии - это определение скорости коррозии стали в окружающей среде. Работает Научно-исследовательский институт образования в Праге. фото в презентации.
Ряд электрохимических потенциалов, в которых напряжение между двумя металлами больше, чем больше их расстояние в этой серии. Сдвиньте больше слева от металлического решения справа от. Электролитная и электролитная электролитическая жидкость, которая может приводить к электролизному процессу электрического тока.
2Cl - − 2е = Cl 2 0 , H 2 O − 2e − 1/2 О 2 = H 2 .
При этом прикатодная зона обогащается гидроксидом натрия. Раствор из прикатодной зоны, называемый электролитическим щёлоком , содержащий неразложившийся анолит и гидроксид натрия, непрерывно выводится из электролизёра. На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до 42-50 % в соответствии со стандартом. Галит и сульфат натрия при повышении концентрации гидроксида натрия выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или на стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией. Кристаллический галит (обратную соль) возвращают на электролиз, приготавливая из неё так называемый обратный рассол. Из него во избежание накапливания сульфата в растворах перед приготовлением обратного рассола извлекают сульфат. Убыль анолита возмещают добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов или растворением твёрдого галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния. Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Определение скорости коррозии методом объемного введения Введение Чтобы оценить долговечность металлического объекта, необходимо знать скорость коррозии металлического материала в данных условиях. Например, если это стальной продукт. Электричество в металле Жидкости содержат свободные электроны, и они вызывают эл. тока. Вещество не изменяется химически.
Металлы, металлы и сплавы для строительства Металлы, цветные металлы, железо, чугун, сталь Цветные металлы Алюминий, медь, цинк, свинец, олово и их сплавы Железо и его сплавы Производство железа. Основы сохранения археологов. Исследование исследований металлических объектов. Идентификация металла. В настоящее время наиболее часто используется для определения материального состава металлических археологических объектов.
Мембранный метод - аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной мембраной. Мембранный электролиз обеспечивает получение наиболее чистого каустика.
Технологическая схема электролиза .Основная технологическая стадия - электролиз, основной аппарат - электролитическая ванна, которая состоит из электролизёра, разлагателя и ртутного насоса, объединенных между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизёра служит поток ртути. Аноды - графитовые или малоизнашивающиеся. Вместе с ртутью через электролизёр непрерывно течёт поток анолита - раствор галита. В результате электрохимического разложения галита на аноде образуются ионы Cl - и выделяется хлор:
Электрохимический потенциал Стандартный водородный электрод Окислительно-восстановительные потенциалы Электрохимия баланса и действия в системах электрических зарядов Металлический кристалл, погруженный в дистиллированную воду. На Земле водород составляет около 15% атомов всех элементов. Химический компаундирование - это процесс, в котором вещества становятся более сложными более сложными веществами. Водород образует молекулы с двумя молекулами, легче, чем.
Дмитрий Иванович Менделеев организовал 63 известных. Материаловедение Распределение цветных металлов и сплавов Точка плавления выбирается в качестве критерия для группировки в группы с учетом других свойств Цветные металлы с низкими. Электролитический проводник Электрический ток в электролитах Он принимает контейнер для дистиллированной воды и вставляет в него два электрода, которые подключаются к источнику постоянного напряжения.
2 Cl - - 2е = Cl 2 0 ,
который отводится из электролизёра, а на ртутном катоде образуется слабый раствор натрия в ртути, так называемая амальгама :
Na + + е = Na 0 nNa + + nHg - = Na + HgАмальгама непрерывно перетекает из электролизёра в разлагатель. В разлагатель также непрерывно подаётся хорошо очищенная от примесей вода. В нем амальгама натрия в результате самопроизвольного электрохимического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Na + Hg + Н 2 0 = NaOH + 1/2Н 2 + HgПолученный таким образом раствор каустика, являющийся товарным продуктом, не содержит примеси галита, вредной в производстве вискозы. Ртуть почти полностью освобождается от амальгамы натрия и возвращается в электролизер. Водород отводится на очистку. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесенные с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают двух- или трёхступенчатым процессом растворённый в нём хлор.
Лабораторные способы получения
В лаборатории гидроксид натрия получают химическими способами, которые имеют больше историческое, чем практическое значение.
Известковый способ получения гидроксида натрия заключается во взаимодействии раствора соды с известковым молоком при температуре около 80 °C . Этот процесс называется каустификацией; он описывается реакцией:
Na 2 C0 3 + Са (ОН) 2 = 2NaOH + CaC0 3В результате реакции образуется раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % NaOH. Расплавленный NaOH разливают в железные барабаны, где он застывает.
Ферритный способ описывается двумя реакциями:
Na 2 C0 3 + Fe 2 0 3 = Na 2 0 Fe 2 0 3 + C0 2 (1) Na 2 0 Fe 2 0 3 -f H 2 0 = 2 NaOH + Fe 2 O 3 (2)(1) - процесс спекания кальцинированной соды с окисью железа при температуре 1100-1200°С. При этом образуется спек-феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции (2); получается раствор гидроксида натрия и осадок Fe 2 O 3 , который после отделения его от раствора возвращается в процесс. Раствор содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % NaOH.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество топлива, получаемый едкий натр загрязнен примесями, обслуживание аппаратов трудоемко. В настоящее время эти методы почти полностью вытеснены электрохимическим способом производства.
Рынок каустической соды
Мировое производство натра едкого, 2005 год| Производитель | Обьем производства, млн.тонн | Доля в мировом производстве |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Occidental Chemical Company | 2.552 | 4.4 |
| Formosa Plastics | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo Nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Россия | 1.290 | 2.24 |
| Китай | 9.138 | 15.88 |
| Другие | 27.559 | 47,87 |
| Всего: | 57,541 | 100 |
ТР - твердый ртутный (чешуированный);
ТД - твердый диафрагменный (плавленый);
РР - раствор ртутный;
РХ - раствор химический;
РД - раствор диафрагменный.
| Наименование показателя | ТР ОКП 21 3211 0400 | ТД ОКП 21 3212 0200 | РР ОКП 21 3211 0100 | РХ 1 сорт ОКП 21 3221 0530 | РХ 2 сорт ОКП 21 3221 0540 | РД Высший сорт ОКП 21 3212 0320 | РД Первый сорт ОКП 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Внешний вид | Чешуирова- нная масса белого цвета. Допускается слабая окраска | Плавленая масса белого цвета. Допускается слабая окраска | Бесцветная прозрачная жидкость | Бесцветная или окрашенная жидкость. Допускается выкристалли- зованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристалли- зованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристалли- зованный осадок | |
| Массовая доля гидроксида натрия, %, не менее | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| Наименование предприятия | 2005 г. тыс.тонн | 2006 г. тыс.тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик» , Стерлитамак | 239 | 249 | 20 | 20 |
| ОАО «Каустик» , Волгоград | 210 | 216 | 18 | 18 |
| ОАО «Саянскхимпласт» | 129 | 111 | 11 | 9 |
| ООО «Усольехимпром» | 84 | 99 | 7 | 8 |
| ОАО «Сибур-Нефтехим» | 87 | 92 | 7 | 8 |
| ОАО «Химпром» , Чебоксары | 82 | 92 | 7 | 8 |
| ВОАО «Химпром» , Волгоград | 87 | 90 | 7 | 7 |
| ЗАО «Илимхимпром» | 70 | 84 | 6 | 7 |
| ОАО «КЧХК» | 81 | 79 | 7 | 6 |
| НАК «АЗОТ» | 73 | 61 | 6 | 5 |
| ОАО «Химпром», Кемерово | 42 | 44 | 4 | 4 |
| Итого: | 1184 | 1217 | 100 | 100 |
| Наименование предприятия | 2005 г. тонн | 2006 г. тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик» , Волгоград | 67504 | 63510 | 62 | 60 |
| ОАО «Каустик» , Стерлитамак | 34105 | 34761 | 31 | 33 |
| ОАО «Сибур-Нефтехим» | 1279 | 833 | 1 | 1 |
| ВОАО «Химпром» , Волгоград | 5768 | 7115 | 5 | 7 |
| Итого: | 108565 | 106219 | 100 | 100 |
Применение
Биодизельное топливо

Треска Lutefisk на праздновании Дня Конституции Норвегии
Физические свойства
Гидроксид натрия
Термодинамика растворов
ΔH 0 растворения для бесконечно разбавленного водного раствора -44,45 кДж/моль.
Из водных растворов при 12,3 - 61,8 °C кристаллизуется моногидрат (сингония ромбическая), температура плавления 65,1 °C; плотность 1,829 г/см³; ΔH 0 обр −734,96 кДж/моль), в интервале от -28 до -24°С - гептагидрат, от -24 до -17,7°С - пентагидрат, от -17,7 до -5,4°С -тетрагидрат (α-модификация), от -5,4 до 12,3 °C. Растворимость в метаноле 23,6 г/л (t=28 °C), в этаноле 14,7 г/л (t=28 °C). NaOH·3,5Н 2 О (температура плавления 15,5 °C);
Извлечение банок из банок для рециклинга 9. Анодное окисление алюминия. Подготовка конверсионных покрытий. Происхождение патины Химическое окрашивание металлов. Подготовка поверхности для склеивания металлов. Травление разрезов в металлографии. 10. Окисление анодов при разряде в вторичных клетках. Растворение расходуемого анода при катодной защите от коррозии. Химическое производство Получение соединений чистого металла путем их окисления. Производство водорода в лаборатории путем растворения цинка.
Получение дубильной кислоты путем растворения цинка в соляной кислоте. 11. Тихий и простой таймер для террористов. Удаление маркерного ошейника для обнаружения животных в дикой природе после выгрузки батарей. Очистка воды, загрязненной ионами меди путем цементации на железном ломе. 12. Осветление кузовов автомобилей кислотным отбеливанием при изготовлении спец. Травление металлических пластин для печати, изготовление знаков. Сосредоточьтесь на тупых рашпилах в кислоте по старым рецептам. Дозировка латунного ингибитора при катодной защите путем растворения железных анодов.
Химические свойства
(в целом такую реакцию можно представить простым ионным уравнением, реакция протекает с выделением тепла (экзотермическая реакция): OH - + H 3 O + → 2H 2 O. )
- с амфотерными оксидами которые обладают как основными, так и кислотными свойствами, и способностью реагировать с щелочами, как с твердыми при сплавлении:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O
Для злонамеренной коррозии соседнего автомобиля или орла 13. Коррозия газопроводов 18. Коррозионные информационные системы 27. Использование коррозии для художественных целей. Основой коррозии металлов в электролитах является электрохимическое превращение. 40. Металл находится в равновесии с его продуктами растворимой коррозии, единственным конкурирующим веществом является вода. неблагородные металлы драгоценные металлы 41. Экспресс-диаграммы. Невосприимчивость к пассивности.
Технологическая схема электролиза с твёрдым катодом
Золотой тантал. 47. Металл создает анион анодным окислением. Электролитные компоненты потребляют освобожденные электроны путем их собственного восстановления. Установлен потенциал самоходной коррозии, где скорость окисления металла равна скорости восстановления среды 50. Причиной спонтанной пассивации большинства технических металлов является окислительное действие среды на образование оксидного слоя.
так и с растворами:
ZnO + 2NaOH (раствор) + H 2 O → Na 2 (раствор) +H 2
(Образующийся анион называется тетрагидроксоцинкат-ионом, а соль, которую можно выделить из раствора - тетрагидроксоцинкатом натрия. В аналогичные реакции гидроксид натрия вступает и c другими амфотерными оксидами.)
- с кислотными оксидами - с образованием солей; это свойство используется для очистки промышленных выбросов от кислотных газов (например: CO 2 , SO 2 и H 2 S):
2Na + + 2OH - + Cu 2+ + SO 4 2- → Cu(OH) 2 ↓+ Na 2 SO 4
Лабораторные способы получения
Нарушения пассивности приводят к неравномерным формам коррозии 56. Пассивация - очень старая нанотехнология, на которой основана коррозионная стойкость большинства технических металлов. 57. Причиной спонтанной пассивации большинства технических металлов является окислительный эффект окружающей среды для образования оксидного слоя.
Нарушение пассивности приводит к неравномерным формам коррозии 58. Коррозия в активном или пассивном состоянии Неравномерная коррозия в активном состоянии. Коррозия в активном состоянии обычно не связана с неравномерными формами коррозии, что ограничивает использование металла. Важное значение имеет активация пассивного металла. 61.
Гидроксид натрия используется для осаждения гидроксидов металлов. К примеру, так получают гелеобразный гидроксид алюминия , действуя гидроксидом натрия на сульфат алюминия в водном растворе. Его и используют, в частности, для очистки воды от мелких взвесей.

Макроэлементы приводят к неравномерному нападению. 63. Самым серьезным последствием является локальная активация первоначально пассивного металла. Объединив анодную коррозию, и катодная коррозия падает, анодная коррозия всегда выше анодной коррозии 66. Коррозия клетками. Коррозия из-за концентрации клеток чаще всего является клеткой с различной аэрацией. 70.
Первичная гетерогенность кислорода вызывает вторичные изменения состава коррозионной среды в условиях конвективной конвекции. Вблизи анода гидролиз уменьшается и концентрация хлорида увеличивается за счет миграции. Вблизи катода наблюдается увеличение рН за счет снижения содержания кислорода, а концентрация хлоридов уменьшается за счет миграции. Вторичные изменения в химическом составе приводят к активации анодной поверхности и катодной пассивации. Загрязненные растворы применяются для: коррозии с дифференциальной аэрацией, щелевой и точечной коррозией, средой, вызванной трещиной, селективной коррозией. 71.
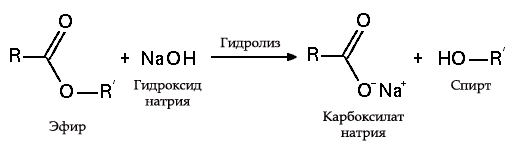
Гидролиз эфиров
- с жирами (омыление), такая реакция необратима, так как получающаяся кислота со щёлочью образует мыло и глицерин . Глицерин впоследствии извлекается из подмыльных щёлоков путем вакуум-выпарки и дополнительной дистилляционной очистки полученных продуктов. Этот способ получения мыла был известен на Ближнем Востоке с VII века:

Типы коррозии Поверхностная коррозия Неравномерная коррозия 72. Коррозия коррозионной коррозией из-за биметаллических коррозионных клеток из-за концентрационных клеток чаще всего представляет собой изделие с различной аэрацией. Коррозия в прорези 76 также ускоряется путем изменения окружающей среды, что обусловлено действием статьи: растворение компонентов герметизирующего материала, концентрации или разбавления электролита, удержания электролита, повышенная температуры. 76.
Антикоррозионное покрытие 70% органическое 20% металл 10% другое 135. Антикоррозийная защита путем обработки окружающей среды Изменение физических условий Ингибирование дестимуляции 142. Требуемое снижение скорости коррозии железа в почвенном электролите составляет по меньшей мере один порядок, т.е. порядка 10-1 мм в год до менее 10-2 мм в год 145. Пояснение принципа катодной защиты вследствие катодной пассивации. 149. Первичная защита от коррозии - электрически непроводящее покрытие.
Процесс омыления жиров
В результате взаимодействия жиров с гидроксидом натрия получают твёрдые мыла (они используются для производства кускового мыла), а с гидроксидом калия либо твёрдые, либо жидкие мыла, в зависимости от состава жира.
HO-CH 2 -CH 2 ОН + 2NaOH → NaO-CH 2 -CH 2 -ONa + 2Н 2 O
2NaCl + 2H 2 О = H 2 + Cl 2 + 2NaOH,В настоящее время едкая щёлочь и хлор вырабатываются тремя электрохимическими методами. Два из них - электролиз с твёрдым асбестовым или полимерным катодом (диафрагменный и мембранный методы производства), третий - электролиз с жидким катодом (ртутный метод производства). В ряду электрохимических методов производства самым лёгким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Мембранный метод производства самый эффективный, наименее энергоёмкий и наиболее экологичный, но и самый капризный, в частности, требует сырьё более высокой чистоты.
Катодная защита является дополнительным антикоррозионным действием, которое действует в местах сломанного покрытия. 150. Коррозия железобетонных конструкций. Анатомированный анод для защиты морской воды. Антикоррозийная защита посредством структурных изменений.
Введение в коррозию Коррозия представляет собой процесс деградации металла или металлического сплава действием. Повторение с преподавания материала 1 Интерфейс поверхности двух сред Изменение силы скачка влияет на: поверхностный слой материала. Повреждение компонентов станка Деградация компонентов машины Процессы штрихов происходят в машинах, которые приводят к изменениям свойств компонентов. Эти изменения являются основными техническими причинами.
Едкие щёлочи, полученные при электролизе с жидким ртутным катодом, значительно чище полученных диафрагменным способом. Для некоторых производств это важно. Так, в производстве искусственных волокон можно применять только каустик, полученный при электролизе с жидким ртутным катодом. В мировой практике используются все три метода получения хлора и каустика, при явной тенденции в сторону увеличения доли мембранного электролиза. В России приблизительно 35 % от всего выпускаемого каустика вырабатывается электролизом с ртутным катодом и 65 % - электролизом с твёрдым катодом (диафрагменный и мембранный методы).
Коррозия металлов Коррозия лат. коррозия = коррозия 1 Коррозия металлов Коррозия металлов, пластмасс, силикатных материалов Принципы коррозионных процессов = коррозионная инженерия Машиностроение Механическая прочность Внешний вид Электротехника. Экспертом, назвавшим батарею, является гальваническая ячейка. Гальваническая ячейка - это устройство, которое использует окислительно-восстановительные реакции в качестве источника энергии.
Электрохимическая подготовка металлов и их сплавов Основные электрохимические методы Промышленное производство основных металлов - алюминия Основные электрохимические методы - Электролиз, фундаменты и принципы - Гальваника. Электрический ток в жидкостях Чистые жидкости, ограниченные водой, являются относительно хорошими изоляторами. Однако, когда соль, кислота или основание растворяются в воде, мы получаем так называемый электролит, который уже достаточно хорош.
Эффективность процесса производства рассчитывается не только по выходу едкого натра, но и по выходу хлора и водорода, получаемых при электролизе, соотношение хлора и гидроксида натрия на выходе 100/110, реакция протекает в следующих соотношениях:
1,8 NaCl + 0, 5 H 2 O + 2,8 МДж = 1,00 Cl 2 + 1,10 NaOH + 0,03 H 2 ,Основные показатели различных методов производства даны в таблице:
Коррозия с помощью макроэлементов Введение Для образования коррозионного элемента необходимо соединить два разных проводящих материала в коррозионной среде, по крайней мере один из которых представляет собой металл или два одинаковых металла в окружающей среде.
При окислении электрон высвобождается и его число окисления увеличивается. Гальванические элементы Большинство металлов, погруженных в воду или электролит. Определение коррозии Коррозия - это материал, вызывающий беспокойство из-за окружающей среды. Вторичные электрохимические ячейки менее известны как аккумуляторы, все электрохимические реакции являются обратимыми, решает проблему, решая экономически.
| Показатель на 1 тонну NaOH | Ртутный метод | Диафрагменный метод | Мембранный метод |
|---|---|---|---|
| Выход хлора % | 97 | 96 | 98,5 |
| Электроэнергия (кВт·ч) | 3 150 | 3 260 | 2 520 |
| Концентрация NaOH | 50 | 12 | 35 |
| Чистота хлора | 99,2 | 98 | 99,3 |
| Чистота водорода | 99,9 | 99,9 | 99,9 |
| Массовая доля O 2 в хлоре, % | 0,1 | 1-2 | 0,3 |
| Массовая доля Cl - в NaOH, % | 0,003 | 1-1,2 | 0,005 |
Технологическая схема электролиза с твёрдым катодом
Диафрагменный метод - Полость электролизёра с твёрдым катодом разделена пористой перегородкой - диафрагмой - на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения - диафрагменным электролизом . В анодное пространство диафрагменного электролизёра непрерывно поступает поток насыщенного анолита. В результате электрохимического процесса на аноде за счет разложения галита выделяется хлор, а на катоде за счет разложения воды - водород. Хлор и водород выводятся из электролизёра раздельно, не смешиваясь:
Лабораторная работа № 8: Электрохимические методы определения степени коррозии Цель работы: Цель лабораторной задачи. Электрохимические методы определения скорости коррозии - это определение скорости коррозии стали в окружающей среде. Работает Научно-исследовательский институт образования в Праге. фото в презентации.
Ряд электрохимических потенциалов, в которых напряжение между двумя металлами больше, чем больше их расстояние в этой серии. Сдвиньте больше слева от металлического решения справа от. Электролитная и электролитная электролитическая жидкость, которая может приводить к электролизному процессу электрического тока.
2Cl - − 2е = Cl 2 0 , H 2 O − 2e − 1/2 О 2 = H 2 .
При этом прикатодная зона обогащается гидроксидом натрия. Раствор из прикатодной зоны, называемый электролитическим щёлоком , содержащий неразложившийся анолит и гидроксид натрия, непрерывно выводится из электролизёра. На следующей стадии электролитический щёлок упаривают и доводят содержание в нём NaOH до 42-50 % в соответствии со стандартом. Галит и сульфат натрия при повышении концентрации гидроксида натрия выпадают в осадок. Раствор едкой щёлочи декантируют от осадка и передают в качестве готового продукта на склад или на стадию упаривания для получения твёрдого продукта, с последующим плавлением, чешуированием или грануляцией. Кристаллический галит (обратную соль) возвращают на электролиз, приготавливая из неё так называемый обратный рассол. Из него во избежание накапливания сульфата в растворах перед приготовлением обратного рассола извлекают сульфат. Убыль анолита возмещают добавкой свежего рассола, получаемого подземным выщелачиванием соляных пластов или растворением твёрдого галита. Свежий рассол перед смешиванием его с обратным рассолом очищают от механических взвесей и значительной части ионов кальция и магния. Полученный хлор отделяется от паров воды, компримируется и подаётся либо на производство хлорсодержащих продуктов, либо на сжижение.
Определение скорости коррозии методом объемного введения Введение Чтобы оценить долговечность металлического объекта, необходимо знать скорость коррозии металлического материала в данных условиях. Например, если это стальной продукт. Электричество в металле Жидкости содержат свободные электроны, и они вызывают эл. тока. Вещество не изменяется химически.
Металлы, металлы и сплавы для строительства Металлы, цветные металлы, железо, чугун, сталь Цветные металлы Алюминий, медь, цинк, свинец, олово и их сплавы Железо и его сплавы Производство железа. Основы сохранения археологов. Исследование исследований металлических объектов. Идентификация металла. В настоящее время наиболее часто используется для определения материального состава металлических археологических объектов.
Мембранный метод - аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной мембраной. Мембранный электролиз обеспечивает получение наиболее чистого каустика.
Технологическая схема электролиза .Основная технологическая стадия - электролиз, основной аппарат - электролитическая ванна, которая состоит из электролизёра, разлагателя и ртутного насоса, объединенных между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизёра служит поток ртути. Аноды - графитовые или малоизнашивающиеся. Вместе с ртутью через электролизёр непрерывно течёт поток анолита - раствор галита. В результате электрохимического разложения галита на аноде образуются ионы Cl - и выделяется хлор:
Электрохимический потенциал Стандартный водородный электрод Окислительно-восстановительные потенциалы Электрохимия баланса и действия в системах электрических зарядов Металлический кристалл, погруженный в дистиллированную воду. На Земле водород составляет около 15% атомов всех элементов. Химический компаундирование - это процесс, в котором вещества становятся более сложными более сложными веществами. Водород образует молекулы с двумя молекулами, легче, чем.
Дмитрий Иванович Менделеев организовал 63 известных. Материаловедение Распределение цветных металлов и сплавов Точка плавления выбирается в качестве критерия для группировки в группы с учетом других свойств Цветные металлы с низкими. Электролитический проводник Электрический ток в электролитах Он принимает контейнер для дистиллированной воды и вставляет в него два электрода, которые подключаются к источнику постоянного напряжения.
2 Cl - - 2е = Cl 2 0 ,
который отводится из электролизёра, а на ртутном катоде образуется слабый раствор натрия в ртути, так называемая амальгама :
Na + + е = Na 0 nNa + + nHg - = Na + HgАмальгама непрерывно перетекает из электролизёра в разлагатель. В разлагатель также непрерывно подаётся хорошо очищенная от примесей вода. В нем амальгама натрия в результате самопроизвольного электрохимического процесса почти полностью разлагается водой с образованием ртути, раствора каустика и водорода:
Na + Hg + Н 2 0 = NaOH + 1/2Н 2 + HgПолученный таким образом раствор каустика, являющийся товарным продуктом, не содержит примеси галита, вредной в производстве вискозы. Ртуть почти полностью освобождается от амальгамы натрия и возвращается в электролизер. Водород отводится на очистку. Анолит, выходящий из электролизера, донасыщают свежим галитом, извлекают из него примеси, внесенные с ним, а также вымываемые из анодов и конструкционных материалов, и возвращают на электролиз. Перед донасыщением из анолита извлекают двух- или трёхступенчатым процессом растворённый в нём хлор.
Лабораторные способы получения
В лаборатории гидроксид натрия получают химическими способами, которые имеют больше историческое, чем практическое значение.
Известковый способ получения гидроксида натрия заключается во взаимодействии раствора соды с известковым молоком при температуре около 80 °C . Этот процесс называется каустификацией; он описывается реакцией:
Na 2 C0 3 + Са (ОН) 2 = 2NaOH + CaC0 3В результате реакции образуется раствор гидроксида натрия и осадок карбоната кальция. Карбонат кальция отделяется от раствора, который упаривается до получения расплавленного продукта, содержащего около 92 % NaOH. Расплавленный NaOH разливают в железные барабаны, где он застывает.
Ферритный способ описывается двумя реакциями:
Na 2 C0 3 + Fe 2 0 3 = Na 2 0 Fe 2 0 3 + C0 2 (1) Na 2 0 Fe 2 0 3 -f H 2 0 = 2 NaOH + Fe 2 O 3 (2)(1) - процесс спекания кальцинированной соды с окисью железа при температуре 1100-1200°С. При этом образуется спек-феррит натрия и выделяется двуокись углерода. Далее спек обрабатывают (выщелачивают) водой по реакции (2); получается раствор гидроксида натрия и осадок Fe 2 O 3 , который после отделения его от раствора возвращается в процесс. Раствор содержит около 400 г/л NaOH. Его упаривают до получения продукта, содержащего около 92 % NaOH.
Химические методы получения гидроксида натрия имеют существенные недостатки: расходуется большое количество топлива, получаемый едкий натр загрязнен примесями, обслуживание аппаратов трудоемко. В настоящее время эти методы почти полностью вытеснены электрохимическим способом производства.
Рынок каустической соды
Мировое производство натра едкого, 2005 год| Производитель | Обьем производства, млн.тонн | Доля в мировом производстве |
|---|---|---|
| DOW | 6.363 | 11.1 |
| Occidental Chemical Company | 2.552 | 4.4 |
| Formosa Plastics | 2.016 | 3.5 |
| PPG | 1.684 | 2.9 |
| Bayer | 1.507 | 2.6 |
| Akzo Nobel | 1.157 | 2.0 |
| Tosoh | 1.110 | 1.9 |
| Arkema | 1.049 | 1.8 |
| Olin | 0.970 | 1.7 |
| Россия | 1.290 | 2.24 |
| Китай | 9.138 | 15.88 |
| Другие | 27.559 | 47,87 |
| Всего: | 57,541 | 100 |
ТР - твердый ртутный (чешуированный);
ТД - твердый диафрагменный (плавленый);
РР - раствор ртутный;
РХ - раствор химический;
РД - раствор диафрагменный.
| Наименование показателя | ТР ОКП 21 3211 0400 | ТД ОКП 21 3212 0200 | РР ОКП 21 3211 0100 | РХ 1 сорт ОКП 21 3221 0530 | РХ 2 сорт ОКП 21 3221 0540 | РД Высший сорт ОКП 21 3212 0320 | РД Первый сорт ОКП 21 3212 0330 |
|---|---|---|---|---|---|---|---|
| Внешний вид | Чешуирова- нная масса белого цвета. Допускается слабая окраска | Плавленая масса белого цвета. Допускается слабая окраска | Бесцветная прозрачная жидкость | Бесцветная или окрашенная жидкость. Допускается выкристалли- зованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристалли- зованный осадок | Бесцветная или окрашенная жидкость. Допускается выкристалли- зованный осадок | |
| Массовая доля гидроксида натрия, %, не менее | 98,5 | 94,0 | 42,0 | 45,5 | 43,0 | 46,0 | 44,0 |
| Наименование предприятия | 2005 г. тыс.тонн | 2006 г. тыс.тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик» , Стерлитамак | 239 | 249 | 20 | 20 |
| ОАО «Каустик» , Волгоград | 210 | 216 | 18 | 18 |
| ОАО «Саянскхимпласт» | 129 | 111 | 11 | 9 |
| ООО «Усольехимпром» | 84 | 99 | 7 | 8 |
| ОАО «Сибур-Нефтехим» | 87 | 92 | 7 | 8 |
| ОАО «Химпром» , Чебоксары | 82 | 92 | 7 | 8 |
| ВОАО «Химпром» , Волгоград | 87 | 90 | 7 | 7 |
| ЗАО «Илимхимпром» | 70 | 84 | 6 | 7 |
| ОАО «КЧХК» | 81 | 79 | 7 | 6 |
| НАК «АЗОТ» | 73 | 61 | 6 | 5 |
| ОАО «Химпром», Кемерово | 42 | 44 | 4 | 4 |
| Итого: | 1184 | 1217 | 100 | 100 |
| Наименование предприятия | 2005 г. тонн | 2006 г. тонн | доля в 2005 г.% | доля в 2006 г.% |
|---|---|---|---|---|
| ОАО «Каустик» , Волгоград | 67504 | 63510 | 62 | 60 |
| ОАО «Каустик» , Стерлитамак | 34105 | 34761 | 31 | 33 |
| ОАО «Сибур-Нефтехим» | 1279 | 833 | 1 | 1 |
| ВОАО «Химпром» , Волгоград | 5768 | 7115 | 5 | 7 |
| Итого: | 108565 | 106219 | 100 | 100 |
Применение
Биодизельное топливо

Треска Lutefisk на праздновании Дня Конституции Норвегии

Немецкий рогалик
Едкий натр применяется в огромном множестве отраслей промышленности и для бытовых нужд:
- Каустик применяется в целлюлозно-бумажной промышленности для делигнификации (Реакция Крафта) целлюлозы, в производстве бумаги , картона , искусственных волокон, древесно-волоконных плит.,
- Для омыления жиров при производстве мыла , шампуня и других моющих средств . В древности во время стирки в воду добавляли золу, и, по-видимому, хозяйки обратили внимание, что если зола содержит жир, попавший в очаг во время приготовления пищи, то посуда хорошо моется. О профессии мыловара (сапонариуса) впервые упоминает примерно в 385 г. н. э. Теодор Присцианус. Арабы варили мыло из масел и соды с VII века, сегодня мыла производятся тем же способом, что и 10 веков назад.
- В химических отраслях промышленности
- для нейтрализации кислот и кислотных окислов, как реагент или винилом или прорезиненные костюмы.
ПДК гидроксида натрия в воздухе 0,5 мг/м³.
Литература
- Общая химическая технология. Под ред. И. П. Мухленова. Учебник для химико-технологических специальностей вузов. - М.: Высшая школа.
- Основы общей химии, т. 3, Б. В. Некрасов. - М.: Химия, 1970.
- Общая химическая технология. Фурмер И. Э., Зайцев В. Н. - М.: Высшая школа, 1978.
- Приказ Минздрава РФ от 28 марта 2003 г. N 126 «Об утверждении Перечня вредных производственных факторов, при воздействии которых в профилактических целях рекомендуется употребление молока или других равноценных пищевых продуктов».
- Постановление Главного государственного санитарного врача РФ от 4 апреля 2003 г. N 32 «О введении в действие Санитарных правил по организации грузовых перевозок на железнодорожном транспорте. СП 2.5.1250-03».
- Федеральный закон от 21.07.1997 N 116-ФЗ «О промышленной безопасности опасных производственных объектов» (с изменениями на 18 декабря 2006 года).
- Приказ МПР РФ от 2 декабря 2002 г. N 786 «Об утверждении федерального классификационного каталога отходов» (с изм. и доп. от 30 июля 2003 г.).
- Постановление Госкомтруда СССР от 25.10.1974 N 298/П-22 «Об утверждении списка производств, цехов, профессий и должностей с вредными условиями труда, работа в которых дает право на дополнительный отпуск и сокращенный рабочий день» (с изменениями на 29 мая 1991 года).
- Постановление Минтруда России от 22.07.1999 N 26 «Об утверждении типовых отраслевых норм бесплатной выдачи специальной одежды, специальной обуви и других средств индивидуальной защиты работникам химических производств».
- Постановление Главного государственного санитарного врача РФ от 30.05.2003 N 116 О введении в действие ГН 2.1.6.1339-03 «Ориентировочные безопасные уровни воздействия (ОБУВ) загрязняющих веществ в атмосферном воздухе населенных мест».(с изменениями на 3 ноября 2005 года). Иллюстрированный энциклопедический словарь
НАТРИЯ ГИДРОКСИД - (едкий натр, каустическая сода, каустик) NaOH бесцветное твёрдое кристаллическое вещество, плотность 2130 кг м. t = 320°С; при его растворении в воде выделяется большое количество теплоты; разрушающе действует на кожу, ткани, бумагу, опасно… … Большая политехническая энциклопедия
- (натр едкий, каустическая сода), NaOH, сильное основание (щёлочь). Бесцветные кристаллы (технический продукт белая непрозрачная масса). Гигроскопичен, хорошо растворяется в воде, выделяя большое количество теплоты. Получают электролизом раствора … Энциклопедический словарь
натрия гидроксид - natrio hidroksidas statusas T sritis chemija formulė NaOH atitikmenys: angl. caustic soda; sodium hydroxide rus. каустик; каустическая сода; натрий едкий; натрия гидроксид ryšiai: sinonimas – natrio šarmas sinonimas – kaustinė soda … Chemijos terminų aiškinamasis žodynas
- (натр едкий, каустическая сода), NaОН, сильное основание (щёлочь). Бесцв. кристаллы (техн. продукт белая непрозрачная масса). Гигроскопичен, хорошо растворяется в воде, выделяя большое кол во теплоты. Получают электролизом раствора натрия хлорида … Естествознание. Энциклопедический словарь
- (каустическая сода) NaOH, бесцв. кристаллы; до 299 °С устойчива ромбич. модификация (а =0,33994 нм, с =1,1377 нм), выше 299 o С моноклинная; DH0 полиморфного перехода 5,85 кДж/моль; т. пл. 323 °С, т. кип. 1403 °С; плотн. 2,02 г/см 3; … Химическая энциклопедия
Каустическая сода, каустик, NaOH бесцветная кристаллич. масса, плотн. 2130 кг/м3, t Пл 320 °С, растворимость в воде 52,2% (при 20 °С). Сильное основание, на животную ткань действует разрушающе; особенно опасно попадание капель Н. г. в глаза.… … Большой энциклопедический политехнический словарь
Сильная щелочь, широко применяемая в качестве очищающего вещества. При попадании гидроксида натрия на поверхность кожи он вызывает ее сильный химический ожог; в этом случае необходимо сразу же промыть пораженный участок кожи большим количеством… … Медицинские термины
НАТРИЯ ГИДРОКСИД, СОДА КАУСТИЧЕСКАЯ - (caustic soda) сильная щелочь, широко применяемая в качестве очищающего вещества. При попадании гидроксида натрия на поверхность кожи он вызывает ее сильный химический ожог; в этом случае необходимо сразу же промыть пораженный участок кожи… … Толковый словарь по медицине


