К семейству щёлочноземельных элементов относят кальций, стронций, барий и радий. Д. И. Менделеев включал в это семейство и магний. Щёлочноземельными элементы именуются по той причине, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т. е. являются щелочами. «…Земельными же они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде окисей RO имеют землистый вид», - пояснял Менделеев в «Основах химии».
Щелочные растворы цианида. Решения на основе щелочной меди обладают лучшей мощностью броска, чем кислотные медные растворы. Однако они не могут использоваться при такой высокой плотности тока, как кислотная медь. Они также относительно сложнее контролировать, чем растворы сульфата кислот. Кроме того, цианид включает специальные процедуры обработки и лечения из-за его острых опасностей для здоровья и требований по утилизации отходов. Но процедуры хорошо понятны, и, с осторожностью, цианид можно безопасно обрабатывать.
Общая характеристика элементов II а группы
Типы цианид-медных ванн. Раствор цианид-медь можно использовать как в стойке, так и в бочке. Ванна для ванны с цианидной медью обычно используется для осаждения тонкого, адгезивного слоя, который может полностью покрывать активную металлическую поверхность, такую как цинк или сталь, перед дальнейшей обработкой. Из-за низкой эффективности нанесения покрытия, время нанесения покрытия и, следовательно, толщина осадка часто определяются временем, необходимым для получения полного покрытия.
Общая характеристика элементов II а группы

Металлы главной подгруппы II группы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами.
Максимальная практическая толщина осадка обычно составляет 2-5 мкм. Медный удар служит только в качестве защитного слоя для последующего нанесения покрытия, как правило, медью или никелем. Низкометаллические и высокоцианидные уровни в медных столкновениях ответственны за низкую эффективность, но эти же свойства обеспечивают защиту от несдерживающего погружного слоя меди, образующегося на поверхности, покрытой. Эта формулировка также дает желаемое превосходное покрытие и способность бросать.
Химические источники тока
Но он также может быть использован для обеспечения более толстых отложений, чем может быть получен с цианидными ваннами. Высокоэффективная композиция с более высокой температурой и концентрацией меди, пластин быстрее и может производить более толстые отложения. Однако он имеет более низкую покрывающую способность. Поэтому перед этой ванной следует использовать цианидный удар, когда покрыты части с областями с низкой плотностью плотности. Тенденция заключается в использовании ванн из цианид-меди только для ударов и использования других процессов, таких как кислотная сульфатная медь, для увеличения толщины осадка.
Легко отдают два валентных электрона, и во всех соединениях имеют степень окисления +2
Сильные восстановители
Активность металлов и их восстановительная способность увеличивается в ряду: Be–Mg–Ca–Sr–Ba
К щёлочноземельным металлам относят только кальций, стронций, барий и радий, реже магний
Бериллий по большинству свойств ближе к алюминию
Карбонатная химия. Карбанат, как правило, в виде карбоната натрия, добавляется к ударам и процессам солевой соли в ванне. Он контролирует рН, действуя как буфер и уменьшая поляризацию анода. Карбонат не добавляется в высокоэффективные ванны. Однако карбонат образуется естественным образом во время работы во всех цианидных ваннах. Это является результатом разложения свободного цианида путем гидролиза и цианидного окисления на аноде. Карбонат также накапливается в ванне путем поглощения углекислого газа из атмосферы, что способствует воздушному перемешиванию.
Физические свойства простых веществ
Щелочноземельные металлы (по сравнению со щелочными металлами) обладают более высокими t°пл. и t°кип., потенциалами ионизации, плотностями и твердостью.
Применение щелочноземельных металлов
Удалите карбонаты путем осаждения путем добавления гидроксида кальция или бария с образованием нерастворимых солей кальция или бария. Цианид бария, который также снижает содержание карбонатов, предотвращает увеличение уровня гидроксида в ванне. Другим подходом является охлаждение бани на основе натрия с образованием карбоната натрия, который гораздо менее растворим при более низких температурах. Карбонаты нельзя охлаждать из бани на основе калия, так как карбонат калия слишком растворим. Для процедур осаждения и охлаждения используйте резервуар для обработки, отличный от резервуара для нанесения покрытия.
Химические свойства щелочноземельных металлов + Be
1. Реакция с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием щелочей:
Mg + 2H 2 O – t° → Mg(OH) 2 + H 2
Ca + 2H 2 O → Ca(OH) 2 + H 2
2. Реакция с кислородом.
Это позволяет карбонату оседать перед закачкой раствора для покрытия через фильтр в очищенный резервуар. Аноды, ток. Используйте высокочистые аноды без оксида для высокоэффективного декоративного медного покрытия. Могут использоваться медные шарики или самородки в стальных корзинах или пленочные аноды. Промежуточные стальные аноды с медными анодами для управления накоплением меди в ванне.
Бериллий растворяется в водных растворах щелочей
Также неплохо запаковать аноды, чтобы содержать нерастворимые частицы, поступающие из анодов. Прерывание тока и периодическое обращение выгодны в высокоэффективных процессах, поскольку они помогают обеспечить более яркие и плавные отложения. Циклы прерывания тока обычно составляют 10 секунд и один сбой. Доступны процессы с добавками, которые не требуют текущего прерывания для получения ярких отложений.
Все металлы образуют оксиды RO, барий-пероксид – BaO 2:
2Mg + O 2 → 2MgO
Ba + O 2 → BaO 2
3. С другими неметаллами образуют бинарные соединения:
Be + Cl 2 → BeCl 2 (галогениды)
Ba + S → BaS (сульфиды)
3Mg + N 2 → Mg 3 N 2 (нитриды)
Ca + H 2 → CaH 2 (гидриды)
Ca + 2C → CaC 2 (карбиды)
3Ba + 2P → Ba 3 P 2 (фосфиды)
Бериллий и магний сравнительно медленно реагируют с неметаллами.
Лучший способ - предотвратить проблему в первую очередь. Исключите источник проблемы, чтобы очищать или другие корректирующие меры не нужно было проводить так часто. Все ванны с цианидным медным покрытием, особенно высокоэффективные ванны, чувствительны к загрязняющим веществам. Органические остатки от полировочных смесей, чистящих средств, материалов для резервуаров и стеллажей и других органических веществ также могут загрязнять ванну.
Распространенные соединения щелочноземельных металлов
Непрерывная фильтрация раствора для покрытия через фильтровальную камеру, заполненную приблизительно 7 г активированного углеродного покрытия на один литр раствора для покрытия, удалит небольшое количество некоторых органических веществ. Измените углерод часто и правильно утилизируйте углерод. Как только углерод находится в контакте с цианидным медным электролитом, он загрязнен органическими веществами и цианидом и должен рассматриваться как опасный.
4. Все щелочноземельные металлы растворяются в кислотах:
Ca + 2HCl → CaCl 2 + H 2
Mg + H 2 SO 4 (разб.) → MgSO 4 + H 2
5. Бериллий растворяется в водных растворах щелочей:
Be + 2NaOH + 2H 2 O → Na 2 + H 2
6. Летучие соединения щёлочноземельных металлов придают пламени характерный цвет:
соединения кальция - кирпично-красный, стронция - карминово-красный, а бария - желтовато-зелёный.
Так как это лучше всего выполнять в резервуаре, отличном от резервуара для нанесения покрытия, охлаждение раствора для удаления карбонатов может быть выполнено одновременно. Даже низкие концентрации шестивалентного хрома, которые можно вытащить в ванну на стеллажах, будут давать скучные и пятнистые отложения. Хром быстро восстанавливается до трехвалентной формы и осаждается путем добавления запатентованных восстановителей непосредственно на ванну для нанесения покрытия. Хексавалентный хром также может быть превращен в неактивное трехвалентное состояние с помощью электролиза с высокой токовой плотностью или путем добавления гидросульфита натрия или станнита натрия.

 Бериллий, также как и литий, относится к числу s-элементов. Четвертый электрон, появляющийся в атоме Be, помещается на 2s-орбитали. Энергия ионизации бериллия выше, чем у лития, из-за большего заряда ядра. В сильных основаниях он образует ион-бериллат ВеО 2- 2 . Следовательно, бериллий ‑ металл, но его соединения обладают амфотерностью. Бериллий, хотя и металл, но значительно менее электроположительный, по сравнению с литием.
Бериллий, также как и литий, относится к числу s-элементов. Четвертый электрон, появляющийся в атоме Be, помещается на 2s-орбитали. Энергия ионизации бериллия выше, чем у лития, из-за большего заряда ядра. В сильных основаниях он образует ион-бериллат ВеО 2- 2 . Следовательно, бериллий ‑ металл, но его соединения обладают амфотерностью. Бериллий, хотя и металл, но значительно менее электроположительный, по сравнению с литием.
Существуют спорные доказательства того, что трехвалентный хром, оставшийся в ванне для нанесения покрытия, можно повторно окислить воздухом обратно в шестивалентный хром. Лучшая процедура заключается в осаждении хрома и удалении его путем фильтрации. Загрязнения цинка будут выходить одновременно с медью, вызывая хрупкие и латунные отложения.
Сера и ее соединения вызывают скучные красные отложения в областях с низкой плотностью. Они обычно появляются в отложениях от новых ванн в результате использования нечистых цианидов или выщелачивания загрязнений из танка, стеллажей и анодных мешков. Щелочные, нецианидные растворы. Забота о безопасности рабочих и правительственных постановлениях о цианидах позволила использовать нецианидные котлы. Однако сомнительно, если они могут заменить цианидные процессы во всех приложениях, особенно для литья под давлением из цинкового сплава, из-за образования нелипкого медного осаждения.
Высокой энергией ионизации атома бериллий заметно отличается от остальных элементов ПА-подгруппы (магния и щелочноземельных металлов). Его химия во многом сходна с химией алюминия (диагональное сходство). Таким образом, это элемент с наличием у его соединений амфотерных качеств, среди которых преобладают все же основные.
Электронная конфигурация Mg: 1s 2 2s 2 2p 6 3s 2 по сравнению с натрием имеет одну существенную особенность: двенадцатый электрон помещается на 2s-орбитали, где уже имеется 1е – .
Процесс следует использовать только после тщательного тестирования фактических деталей, подлежащих покрытию, производимых в производственных условиях. Пользователи также должны подтвердить, что запатентованный нецианидный комплексник, используемый для замены цианида, менее опасен и легче утилизировать, чем цианид.
Значение рН составляет около 0, в то время как растворы цианид-меди имеют рН, по меньшей мере. Анализ и рутинные добавления сложного эфира - все, что обычно необходимо для поддержания ванны. Однако удаление металлических примесей может быть серьезной проблемой для некоторых процессов.
Ионы магния и кальция ‑ незаменимые элементы жизнедеятельности любой клетки. Их соотношение в организме должно быть строго определённым. Ионы магния участвуют в деятельности ферментов (например, карбоксилазы), кальция – в построении скелета и обмена веществ. Повышение содержания кальция улучшает усвоение пищи. Кальций возбуждает и регулирует работу сердца. Его избыток резко усиливает деятельность сердца. Магний играет отчасти роль антагониста кальция. Введение ионов Mg 2+ под кожу вызывает наркоз без периода возбуждения, паралич мышц, нервов и сердца. Попадая в рану в форме металла, он вызывает долго незаживающие гнойные процессы. Оксид магния в лёгких вызывает так называемую литейную лихорадку. Частый контакт поверхности кожи с его соединениями приводит к дерматитам. Самые широко используемые в медицине соли кальция: сульфат СаSO 4 и хлорид CaCL 2 . Первый используется для гипсовых повязок, а второй применяется для внутривенных вливаний и как внутреннее средство. Он помогает бороться с отёками, воспалениями, аллергией, снимает спазмы сердечно-сосудистой системы, улучшает свертываемость крови.
Кислотные растворы меди. Кислотные медные ванны представляют собой простые составы, содержащие ионы меди, добавки и либо сульфатные, либо флуоборатные ионы вместе с соответствующими кислотами. Из-за их кислотности их нельзя наносить непосредственно на активные металлы, такие как литье под давлением цинка и сталь, поскольку они будут производить не прилипающие иммерсионные отложения.
Химическая стоимость кислотно-медных ванн низкая, и они могут иметь широкий диапазон в составе. По сравнению с цианидными и щелочными нецианидными ваннами их контроль потока является более простым, их легче контролировать, и они более стабильны. Их эффективность анода и катода высокая, близкая или равная 100%. При высоком перемешивании они могут переносить большие плотности тока.
Все соединения бария, кроме BaSO 4 , ядовиты. Вызывают менегоэнцефалит с поражением мозжечка, поражение гладких сердечных мышц, паралич, а в больших дозах – дегенеративные изменения печени. В малых же дозах соединения бария стимулируют деятельность костного мозга.
При введении в желудок соединений стронция наступает его расстройство, паралич, рвота; поражения по признакам сходны с поражениями от солей бария, но соли стронция менее токсичны. Особую тревогу вызывает появление в организме радиоактивного изотопа стронция 90 Sr. Он исключительно медленно выводится из организма, а его большой период полураспада и, следовательно, длительность действия могут служить причиной лучевой болезни.
Однако из-за их низкой катодной поляризации кислотные ванны не обладают такой же способностью, как щелочные растворы, что делает их плохими ваннами. Ванны общего назначения используются для декоративного покрытия, а высокоскоростные и высокоскоростные ванны предназначены для специальных применений, таких как печатная плата и полоскание. Ванны с высокими выбросами составлены для того, чтобы покрывать больше меди в отверстиях с очень низкой плотностью тока и меньше на поверхности печатных плат, чем в других кислотных медных процессах.
Положение в ПС
Высокоскоростная ванна может плавиться примерно в два раза быстрее, чем обычные ванны, сохраняя при этом все требуемые свойства отложения. Концентрация сульфата меди помогает определить свойства ванн. При более высоких концентрациях удельное сопротивление ванны больше, а анодная и катодная поляризация слегка уменьшаются. При более низких концентрациях сульфата меди мощность броска увеличивается. Растворимость сульфата меди уменьшается с увеличением концентрации серной кислоты.
Радий опасен для организма своим излучением и огромным периодом полураспада (Т 1/2 = 1617 лет). Первоначально после открытия и получения солей радия в более или менее чистом виде его стали использовать довольно широко для рентгеноскопии, лечения опухолей и некоторых тяжёлых заболеваний. Теперь с появлением других более доступных и дешевых материалов применение радия в медицине практически прекратилось. В некоторых случаях его используют для получения радона и как добавку в минеральные удобрения.
Серная кислота придает ванне высокую проводимость, уменьшает анодную и катодную поляризацию и предотвращает осаждение основных солей меди. Агитация, аноды. Для обеспечения яркости и предотвращения горения с высокой токовой плотностью важно перемешивать кислотные медные ванны. Воздушное перемешивание от безмасляного воздуходувки лучше всего подходит для декоративной медной обшивки.
На анодах образуется необходимая черная оксидная пленка. Если это нарушено, например, при чрезмерной плотности тока анода, потребление осветлителя и шероховатость увеличится, пластичность залежи уменьшится, а выравнивание отложений будет уменьшено. Если аноды имеют розовый или светло-серый вид, причиной может быть слишком низкое содержание анодного фосфора или электрические проблемы.
В атоме кальция завершается заполнение 4s-орбитали. Вместе с калием он образует пару s-элементов четвертого периода. Гидроксид кальция ‑ довольно сильное основание. У кальция - наименее активного из всех щелочноземельных металлов - характер связи в соединениях ионный.
По своим характеристикам стронций занимает промежуточное положение между кальцием и барием.
Свойства бария наиболее близки к свойствам щелочных металлов.
Бериллий и магний широко используют в сплавах. Бериллиевые бронзы – упругие сплавы меди с 0,5-3% бериллия; в авиационных сплавах (плотность 1,8) содержится 85-90% магния (“электрон”). Бериллий отличается от остальных металлов IIА группы – не реагирует с водородом и водой, зато растворяется в щелочах, поскольку образует амфотерный гидроксид:
Be+H 2 O+2NaOH=Na 2 +H 2 .
Магний активно реагирует с азотом:
3 Mg + N 2 = Mg 3 N 2 .
В таблице приведена растворимость гидроксидов элементов II группы.
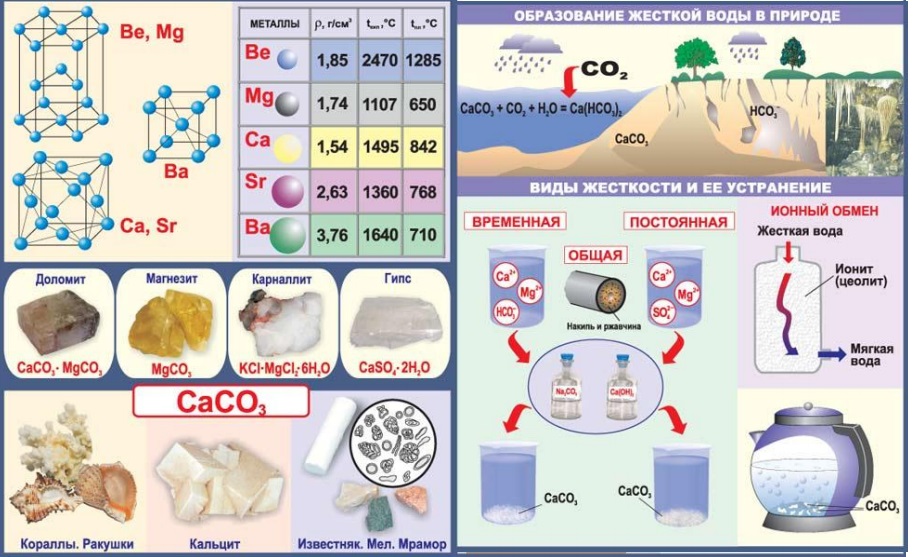
Традиционная техническая проблема – жесткость воды , связанная с наличием в ней ионов Mg 2+ и Ca 2+ . Из гидрокарбонатов и сульфатов на стенках нагревательных котлов и труб с горячей водой оседают карбонаты магния и кальция и сульфат кальция. Особенно мешают они работе лабораторных дистилляторов.
S-элементы в живом организме выполняют важную биологическую функцию. В таблице приведено их содержание.
Во внеклеточной жидкости содержится в 5 раз больше ионов натрия, чем внутри клеток. Изотонический раствор (“физиологическая жидкость”) содержит 0,9% хлорида натрия, его применяют для инъекций, промывания ран и глаз и т. п. Гипертонические растворы (3-10% хлорида натрия) используют как примочки при лечении гнойных ран (“вытягивание” гноя). 98% ионов калия в организме находится внутри клеток и только 2% во внеклеточной жидкости. В день человеку нужно 2,5-5 г калия. В 100 г кураги содержится до 2 г калия. В 100 г жареной картошки – до 0,5 г калия. Во внутриклеточных ферментативных реакциях АТФ и АДФ участвуют в виде магниевых комплексов.
Ежедневно человеку требуется 300-400 мг магния. Он попадает в организм с хлебом (90 мг магния на 100 г хлеба), крупой (в 100 г овсяной крупы до 115 мг магния), орехами (до 230 мг магния на 100 г орехов). Кроме построения костей и зубов на основе гидроксилапатита Ca 10 (PO 4) 6 (OH) 2 , катионы кальция активно участвуют в свертывании крови, передаче нервных импульсов, сокращении мышц. В сутки взрослому человеку нужно потреблять около 1 г кальция. В 100 г твердых сыров содержится 750 мг кальция; в 100 г молока – 120 мг кальция; в 100 г капусты – до 50 мг.
Рассмотрим химические свойства щелочноземельных металлов. Определим особенности их строения, получения, нахождения в природе, применение.
Положение в ПС
Для начала определим расположение этих элементов в Менделеева. Они располагаются во второй группе главной подгруппе. К ним относят кальций, стронций, радий, барий, магний, бериллий. Все они на внешнем энергетическом уровне содержат по два валентных электрона. В общем виде бериллий, магний и щелочноземельные металлы на внешнем уровне имеют ns2 электронов. В химических соединениях они проявляют степень окисления +2. Во время взаимодействия с другими веществами они проявляют восстановительные свойства, отдавая электроны с внешнего энергетического уровня.
Изменение свойств
По мере возрастания ядра атома бериллий, магний и усиливают свои металлические свойства, так как наблюдается возрастание радиуса их атомов. Рассмотрим физические свойства щелочноземельных металлов. Бериллий в обычном состоянии является металлом серого цвета со стальным блеском. Он имеет плотную гексагональную кристаллическую решетку. При контакте с кислородом воздуха, бериллий сразу же образует оксидную пленку, в результате чего снижается его химическая активность, образуется матовый налет.
Физические свойства
Магний в качестве простого вещества является белым металлом, образующим на воздухе оксидное покрытие. Он имеет гексагональную кристаллическую решетку.
Физические свойства щелочноземельных металлов кальция, бария, стронция схожи. Они представляют собой металлы с характерным серебристым блеском, покрывающиеся под воздействием кислорода воздуха желтоватой пленкой. У кальция и стронция кубическая гранецентрированная решетка, барий имеет объемно-центрированную структуру.
Химия щелочноземельных металлов основывается на том, что у них металлический характер связи. Именно поэтому они отличаются высокой электрической и тепло проводимостью. Температуры их плавления и кипения больше, чем у щелочных металлов.

Способы получения
Производство бериллия в промышленных объемах осуществляется путем восстановления металла из фторида. Условием протекания данной химической реакции является предварительное нагревание.
Учитывая, что щелочноземельные металлы в природе находятся в виде соединений, для получения магния, стронция, кальция проводят электролиз расплавов их солей.

Химические свойства
Химические свойства щелочноземельных металлов связаны с необходимостью предварительного устранения с их поверхности слоя оксидной пленки. Именно она определяет инертность данных металлов к воде. Кальций, барий, стронций при растворении в воде образуют гидроксиды, имеющие ярко выраженные основные свойства.
Химические свойства щелочноземельных металлов предполагают их взаимодействие с кислородом. Для бария продуктом взаимодействия является пероксид, для всех остальных после реакции образуются оксиды. У всех представителей данного класса оксиды проявляют основные свойства, только для оксида бериллия характерны амфотерные свойства.
Химические свойства щелочноземельных металлов проявляются и в реакции с серой, галогенами, азотом. При реакциях с кислотами, наблюдается растворение данных элементов. Учитывая, что бериллий относится к амфотерным элементам, он способен вступать в химическое взаимодействие с растворами щелочей.

Качественные реакции
Основные формулы щелочноземельных металлов, рассматриваемые в курсе неорганической химии, связаны с солями. Для выявления представителей данного класса в смеси с другими элементами, можно использовать качественное определение. При внесении солей щелочноземельных металлов в пламя спиртовки, наблюдается окрашивание пламени катионами. Катион стронция дает темный красный оттенок, катион кальция - оранжевый цвет, а катион бария зеленый тон.
Для выявления катиона бария в качественном анализе используют сульфат анионы. В результате данной реакции образуется сульфат бария белого цвета, который нерастворим в неорганических кислотах.
Радий является радиоактивным элементом, который в природе содержится в незначительных количествах. При взаимодействии магния с кислородом, наблюдается ослепительная вспышка. Данный процесс некоторое время применяли во время фотографирования в темных помещениях. Сейчас на смену магниевым вспышкам пришли электрические системы. К семейству щелочноземельных металлов относится бериллий, который реагирует со многими химическими веществами. Кальций и магний аналогично алюминию, могут восстанавливать такие редкие металлы, как титан, вольфрам, молибден, ниобий. Данные называют кальциетермией и магниетермией.

Особенности применения
Каково применение щелочноземельных металлов? Кальций и магний используют для изготовления легких сплавов и редких металлов.
К примеру, магний содержится в составе дюралюминия, а кальций - это компонент свинцовых сплавов, используемых для получения оболочек кабелей и создания подшипников. Широко применение щелочноземельных металлов в технике в виде оксидов. (оксид кальция) и жженая магния (оксид магния) требуются для строительной сферы.
При взаимодействии с водой оксида кальция происходит выделение существенного количества теплоты. Гашеная известь (гидроксид кальция) применяется для строительства. Белая взвесь данного вещества (известковое молоко) применяют в сахарной промышленности для процесса очистки свекловичного сока.

Соли металлов второй группы
Соли магния, бериллия, щелочноземельных металлов можно получить путем взаимодействия с кислотами их оксидов. Хлориды, фториды, иодиды данных элементов являются белыми кристаллическими веществами, в основном хорошо растворимыми в воде. Среди сульфатов растворимостью обладают только соединения магния и бериллия. Наблюдается ее снижение от солей бериллия к сульфатам бария. Карбонаты практически не растворяются в воде либо имеют минимальную растворимость.
Сульфиды щелочноземельных элементов в незначительных количествах содержатся в тяжелых металлах. Если направить на них освещение, можно получить различные цвета. Сульфиды включаются в состав светящихся составов, именуемых фосфорами. Применяют подобные краски для создания светящихся циферблатов, дорожных знаков.
Распространенные соединения щелочноземельных металлов
Карбонат кальция является самым распространенным на земной поверхности элементом. Он является составной частью таких соединений, как известняк, мрамор, мел. Среди них основное применение имеет известняк. Этот минерал незаменим в строительстве, считается отличным строительным камнем. Кроме того, из данного неорганического соединения получают негашеную и гашеную извести, стекло, цемент.
Применение известковой щебенки способствует укреплению дорог, а благодаря порошку можно снизить кислотность почвы. Природный мел представляет собой раковины древнейших животных. Данное соединение используют для изготовления резины, бумаги, создания школьных мелков.
Мрамор востребован у архитекторов, скульпторов. Именно из мрамора были созданы многие уникальные творения Микеланджело. Часть станций московского метро облицована именно мраморными плитками. Карбонат магния в больших объемах используется при изготовлении кирпича, цемента, стекла. Он нужен в металлургической промышленности для удаления пустой породы.
Сульфат кальция, содержащийся в природе в виде гипса (кристаллогидрата сульфата кальция), применяется в строительной отрасли. В медицине данное соединение применяется для изготовления слепков, а также для создания гипсовых повязок.
Алебастр (полуводный гипс) при взаимодействии с водой выделяет огромное количество тепла. Это также применяется в промышленности.
Английская соль (сульфат магния) применяется в медицине в виде слабительного средства. Данное вещество обладает горьким вкусом, оно обнаружено в морской воде.
«Баритовая каша» (сульфат бария) не растворяется в воде. Именно поэтому данную соль применяют в рентгенодиагностике. Соль задерживает рентгеновские лучи, что позволяет выявлять заболевания желудочно-кишечного тракта.
В составе фосфоритов (горной породы) и апатитов есть фосфат кальция. Они нужны для получения соединений кальция: оксидов, гидроксидов.
Кальций играет для живых организмов особое значение. Именно этот металл необходим для построения костного скелета. Ионы кальция необходимы для регулировки работы сердца, повышения свертываемости крови. Недостаток его вызывает нарушения в работе нервной системы, потере свертываемости, утрате способности рук нормально держать различные предметы.
Для того чтобы избежать проблем со здоровьем, каждые сутки человек должен потреблять примерно 1,5 грамма кальция. Основная проблема заключается в том, что для того, чтобы организм усваивал 0,06 грамма кальция, необходимо съедать 1 грамм жира. Максимальное количество данного металла содержится в салате, петрушке, твороге, сыре.

Заключение
Все представители второй группы главной подгруппы таблицы Менделеева необходимы для жизни и деятельности современного человека. Например, магний является стимулятором обменных процессов в организме. Он должен присутствовать в нервной ткани, крови, костях, печени. Магний является активным участником и фотосинтеза у растений, так как он является составной частью хлорофилла. Кости человека составляют примерно пятую часть от общего веса. Именно в них содержится кальций и магний. Оксиды, соли щелочноземельных металлов нашли разнообразное применение в строительной сфере, фармацевтике и медицине.



