Мы отправляем его в воздух и запускаем в космос, ставим на плиту, строим из него здания, изготавливаем шины, мажем на кожу и лечим им язву... Вы еще не поняли? Речь идет об алюминии.
Попробуйте перечислить все области применения алюминия и обязательно ошибетесь. Скорее всего о существовании многих из них вы даже не подозреваете. Все знают, что алюминий - материал авиастроителей. Но как насчет автомобилестроения или, скажем. медицины? Знаете ли вы, что алюминий является пищевой добавкой Е-137, которая обычно используется как краситель, придающий продуктам серебристый оттенок?
Соединение используется в производстве промышленной керамики. Его наиболее распространенная кристаллическая форма имеет несколько вариантов качества драгоценных камней. Существует много различных форм оксида алюминия, включая как кристаллические, так и некристаллические формы. Это электрический изолятор, что означает, что он не проводит электричество, а также имеет относительно высокую теплопроводность. Кроме того, в своей кристаллической форме корунд его твердость делает его пригодным в качестве абразива.
Высокая температура плавления оксида алюминия делает его хорошим огнеупорным материалом для облицовки высокотемпературных приборов, таких как печи, печи, мусоросжигательные установки, реакторы различного сорта и тигли. Наиболее распространенное применение оксида алюминия заключается в производстве металлического алюминия. Металлический алюминий реагирует, что может вызвать коррозию. Однако, когда алюминий связывается с кислородом с образованием оксида алюминия, он создает тонкое покрытие, которое защищает его от окисления.
Алюминий - элемент, который с легкостью образует устойчивые соединения с любыми металлами, кислородом, водородом, хлором и многими другими веществами. В результате подобных химических и физических воздействий получаются диаметрально разные по своим свойствам сплавы и соединения.
Использование оксидов и гидроксидов алюминия
Сферы применения алюминия настолько обширны, что для ограждения товаропроизводителей, конструкторов и инженеров от непреднамеренных ошибок, в нашей стране применение маркировки сплавов алюминия - стало обязательным. Каждому сплаву или соединению присваивается свое буквенно-цифровое обозначение, которое в дальнейшем позволяет быстро отсортировать их и направить для дальнейшей обработки.
Это удерживает алюминий от коррозии и потери силы. Толщина и другие свойства оксидного слоя могут быть изменены с использованием процесса анодирования. Оксид алюминия также является продуктом процесса плавки алюминия. Наиболее распространенной кристаллической формой оксида алюминия является корунд. Оба они представляют собой драгоценные формы корунда. Они обязаны своей отличительной окраской отслеживать загрязнения. Рубины получают свой глубокий красный цвет и лазерные качества от следов хрома. Сапфиры бывают разных цветов, которые исходят от других примесей, таких как железо и титан.
Наиболее распространенные природные соединения алюминия - его оксид и гидроксид. в природе они существуют исключительно в виде минералов - корундов, бокситов, нефелинов, пр. - и в качестве глинозема. Применение алюминия и его соединений связано с ювелирной, косметологической, медицинской сферами, химической промышленностью и строительством.
Твердость различных видов делает их пригодными для использования в качестве абразивов и компонентов в режущих инструментах. Оксид алюминия, также называемый оксидом алюминия, используется в инженерной керамике. Он прочный и износостойкий, выдерживает приступы как кислотных, так и щелочных веществ, обладает высокой прочностью и жесткостью и обладает хорошей теплопроводностью, что делает его ценным при производстве различных керамических изделий. К ним относятся такие вещи, как высокотемпературные электрические и изоляторы напряжения, контрольно-измерительные приборы для термических испытательных машин, уплотнительные кольца, газовые лазерные трубки и другое лабораторное оборудование.
Цветные, "чистые" (не мутные) корунды - это известные всем нам драгоценности - рубины и сапфиры. Однако по своей сути они - не что иное, как самый обычный оксид алюминия. Помимо ювелирной сферы, применение оксида алюминия распространяется на хим.промышленность, где он обычно выступает адсорбентом, а также на производство керамической посуды. Керамические котелки, горшочки, чашки обладают замечательными жаропрочными свойствами именно благодаря содержащемуся в них алюминию. Свое применение окись алюминия нашла и как материал для изготовления катализаторов. Нередко оксиды алюминия добавляют в бетон для его лучшего затвердевания, а стекло, в которое добавили алюминий, становится жаропрочным.
Оксид алюминия также используется в производстве баллистических брони. Поскольку оксид алюминия является довольно инертным химически, белым и относительно нетоксичным, он служит в качестве наполнителя для пластмасс. Это также общий ингредиент в солнцезащитном креме. Благодаря своей твердости и прочности, он используется в качестве абразива, в том числе на наждачной бумаге и в качестве менее дорогого заменителя промышленных алмазов. Те же качества делают его хорошим ингредиентом в зубной пасте. Стоматологи используют оксид алюминия в качестве полирующего средства для удаления зубных пятен.
Перечень областей применения гидроксида алюминия выглядит еще более внушительно. Благодаря способности поглощать кислоту и оказывать каталитическое действие на иммунитет человека, гидроксид алюминия используется при изготовлении лекарств и вакцин от гепатитов типа "А" и "В" и столбнячной инфекции. Им также лечат почечную недостаточность, обусловленную наличием большого числа фосфатов в организме. Попадая в организм, гидроксид алюминия вступает в реакцию с фосфатами и образует неразрывные с ними связи, а затем естественным путем выводится из организма.
Оксид алюминия имеет множество целей. Самым важным является производство металлического алюминия, но это, конечно, не единственный. Хотя вы, возможно, и не знаете, как рубины, так и сапфиры состоят из оксида алюминия, что делает его очень ценным элементом!
В химии вес формулы представляет собой величину, рассчитанную путем умножения атомного веса каждого элемента в химической формуле на число атомов этого элемента, присутствующих в формуле, а затем добавление всех этих продуктов вместе. Обычным запросом на этом сайте является преобразование граммов в родинок. Чтобы завершить этот расчет, вы должны знать, какую субстанцию вы пытаетесь преобразовать. Причина в том, что молярная масса вещества влияет на конверсию. Этот сайт объясняет, как найти молярную массу.
Гидроксид, в виду его отличной растворимости и не токсичности, нередко добавляют в пасту для чистки зубов, шампунь, мыло, примешивают к солнцезащитным средствам, питательным и увлажняющим кремам для лица и тела, антиперсперантам, тоникам, очищающим лосьонам, пенкам и пр. Если необходимо равномерно и стойко окрасить ткань, то в краситель добавляют немного гидроксида алюминия и цвет буквально "втравляется" в поверхность материи.
Поиск молярной массы начинается с единиц граммов на моль. При расчете молекулярной массы химического соединения он сообщает нам, сколько граммов находится в одном моле этого вещества. Вес формулы - это просто вес атомных единиц массы всех атомов в данной формуле.
Используя химическую формулу соединения и периодическую таблицу элементов, мы можем добавить атомные веса и вычислить молекулярную массу вещества. Если формула, используемая при расчете молярной массы, является молекулярной формулой, рассчитанная масса формулы представляет собой молекулярную массу. Процентное содержание любого атома или группы атомов в соединении может быть вычислено путем деления общей массы атома в формуле на вес формулы и умножения на.
Применение хлоридов и судьфатов алюминия
Крайне важными соединениями алюминия являются также хлориды и сульфаты. Хлорид алюминия в естественном состоянии не встречается, однако его довольно просто получить промышленным путем из бокситов и каолинов. Применение хлорида алюминия ввиде катализатора довольно однобоко, но практически бесценно для нефтеперерабатывающей отрасли.
Мы используем наиболее распространенные изотопы. Вот как рассчитать молярную массу, основанную на изотропно взвешенных средних. Это не то же самое, что молекулярная масса, представляющая собой массу одной молекулы четко определенных изотопов. Для объемных стехиометрических расчетов мы обычно определяем молярную массу, которую можно также назвать стандартным атомным весом или средней атомной массой.
Использование оксидов и гидроксидов алюминия
Вес формулы особенно полезен при определении относительных масс реагентов и продуктов в химической реакции. Эти относительные веса, вычисленные из химического уравнения, иногда называются весами уравнений. В керамике принято выражать композиции разных веществ в виде комбинации оксидов, которые их образуют. Причина в том, что при приготовлении пищи с использованием энергии калорий различное сырье, в том числе сама глина, разлагается и рекомбинируется, причем оксиды являются основными единицами таких разложений и рекомбинаций.

Алюминиевые сульфаты существуют в естественном состоянии в качестве минералов вулканических пород и известны своей способностью к абсорбации воды из воздуха. Применение сернокислого алюминия распространяется на косметическую и текстильную промышленность. В первой, он выступает в качестве добавки в антиперсперанды, во второй - в виде красителя. Интересно применение сульфата алюминия в составе реппелентов от насекомых. Сульфаты не только отпугивают комаров, мух и мошек, но и обезболивают место укуса. Однако несмотря на ощутимую пользу, сульфаты алюминия неоднозначно действуют на здоровье людей. Если вдохнуть или проглотить сульфат алюминия, можно получить серьезное отравление.
Кроме того, кислород, который является очень обильным и реактивным элементом, заставляет все окисляться, то есть сочетаться с кислородом, когда температура достаточно высока в печи. Керамист распознает глину как материал с рядом характерных свойств. Химик понимает это как сложную смесь минералов. Этот последний анализ предлагает дополнительную информацию о возможных свойствах глины.
Например, кусок глины ледникового происхождения может быть выражен следующими анализами. Первый из анализов выражает процентный состав оксидов, аналогичный графику, который сравнивает состав земной коры с типичным составом красной грязи. Вторая форма, называемая «рациональным анализом», выражает минеральный состав глины, но теоретически получена из первого и физико-химических свойств глины.

Алюминиевые сплавы - основные области применения
Искусственно полученные соединения алюминия с металлами (сплавы), в отличие от естественных образований, могут иметь такие свойства, какие пожелает сам производитель - достаточно изменить состав и количество легирующих элементов. На сегодняшний день существуют практически безграничные возможности для получения сплавов алюминия и их применения.
Геологическое происхождение глины
Другие общие понятия следующие: изоморфизм. Он называется явлением, согласно которому вещества, которые, хотя и имеют различный химический состав, создают кристаллы, которые имеют сходную форму и структуру. Говорят, что это изоструктурные вещества. Изоморфизм встречается довольно часто среди филлосиликатов, которые развивают изоморфный ряд между двумя членами разного состава: монтморилонит-бейделлит, бейделлит-монтронит и т.д. также представлены изоморфные ряды между силикатами и гермонатами. Полиморфизм.
Самая известная отрасль использования алюминиевых сплавов - авиастроение. Самолеты практически полностью изготовлены из алюминиевых сплавов. Сплавы цинка, магния и алюминия дают небывалую прочность, используемую в обшивке самолетов и изготовлении деталей конструкции.
Аналогично используются алюминиевые сплавы и в строении кораблей, подводных лодок и мелкого речного транспорта. Здесь из алюминия наиболее выгодно делать надстроечные конструкции, они более чем в половину снижают вес судна, при этом не ухудшая их надежности.
Это называется тем явлением, согласно которому химическое вещество производит различные кристаллические формы. Хотя состав полиморфов одинаковый, их физические свойства различны. Полиморфная модификация обусловлена изменением условий, таких как температура или давление во время кристаллизации единичных частиц, так что они принимают различное распределение. Примером может служить кальцит, который кристаллизуется в ромбоэдрической системе и арагонит, который делает его в ромбическом. Кварц имеет два полиморфных разновидности: тридимит гексагональный, а кристобалит - кубический.
Подобно самолетам и кораблям, автомобили с каждым годом все больше и больше становятся "алюминиевыми". Алюминий применяется не только в деталях кузова, теперь это еще и рамы, балки, стойки и панели кабины. Благодаря химической инертности алюминиевых сплавов, низкой подверженности коррозии и теплоизоляционным свойствам из сплавов алюминия изготавливают цистерны для перевозок жидких продуктов.
Сам кварц является тригональным с ромбоэдрическими гранями. Когда полиморфизм происходит в одном элементе, он называется аллотропией. Примерами являются серу, которая может кристаллизоваться в румбической или моноклональной системе, а также кислород и озон, которые являются алотропными формами одного и того же элемента. Известны также алотрипические состояния фосфора. Политипизм - особая форма полиморфизма. Модификация структуры подразумевает разницу в распределении стека одинаковых листов или слоев.
Это распространенное явление в большинстве филлосиликатов, таких как слюды, каолины, хлориты и т.д. изоморфная или диадуцическая замена. Редко встречаются чистые минералы в природе. В общем, один или несколько ионов в определенной степени заменяются другими ионами, причем замены являются существенно катионными. Такое замещение одного иона другим в кристалле, сохраняя ту же структуру, является тем, что называется изоморфной заменой. Изоморфное замещение происходит очень часто в силикатах и других минералах, которые не проявляют постоянства в химическом составе и могут быть частичными или полными.

Широко известно применение алюминия в промышленности. Нефте- и газодобыча не были бы такими как сейчас, если бы не чрезвычайно коррозионстойкие, химически инертные трубопроводы из алюминиевых сплавов. Буры, сделанные из алюминия, весят в несколько раз меньше, а значит легко перевозятся и монтируются. И это не говря уже о разного рода, резервуарах, котлах и прочих емкостях...
В общем, можно заменить другой, когда его ионные радиостанции отличаются менее чем на 15%. Такие замены не изменяют электрический баланс. Часто нижний валентный катетер заменяет другой валентный, который изменяет электрический баланс и должен быть компенсирован введением дополнительных катионов. Это относится к полевым шпатам, где некоторые силиконы заменяются алюминием, а калий или натрий вводят для достижения электронейтральности.
Следует, наконец, отметить, что изоморфные замены в силикатах происходят во время их генезиса. После обучения замена иона является очень медленным процессом. Не путайте диадуцическое замещение ионообменом, что является по существу внешним явлением. Неопорядоченный каолинит представляет собой глинистый минерал, подвергшийся изоморфному замещению. Вместо этого примерно один из десяти атомов алюминия заменяется железом или, в меньшей степени, титаном; и примерно каждый пятьдесят атомов кремния заменяются алюминием.
Из алюминия и его сплавов производят кастрюли, сковороды, противни, половники и прочую домашнюю утварь. Алюминиевая посуда отлично проводит тепло, очень быстро нагревается, при этом легко чистится, не вредит здоровью и продуктам. На алюминиевой фольге мы запекаем мясо в духовке и выпекаем пироги, в алюминий упакованы масла и маргарины, сыры, шоколад и конфеты.
В результате недостаток равновесия компенсируется магнием или другими двухвалентными атомами, которые связаны в пустотах слоя двуокиси кремния. Дезорганизованный кристалл каолинита искажен и, следовательно, не столь компактен, как другие кристаллы одного и того же вида. Конечным результатом является более слабая структура не только внутри кристалла, но и минеральных частиц. В отличие от упорядоченного каолинита, который образует крупные частицы правильных форм, дезорганизованный каолинит имеет довольно случайные формы и агрегаты.
Вода элементов может легче проникать в ее структуру, чтобы разорвать ее до очень тонкого размера, который образует очень пластичные глины. Неупорядоченные каолиниты, подвергнутые процессу введения и транспортировки, образуют некоторые очень пластичные глины, такие как, например, шаровая глина.

Крайне важная и перспективная область - применение алюминия в медицине. Помимо тех областей использования (вакцины, почечные лекарства, адсорбенты), о которых говорилось ранее, следует также упомянуть использование алюминия в лекарствах от язвы и изжоги.
Из всего вышесказанного можно сделать один вывод - марки алюминия и их применение слишком многообразны, чтобы посвящать им одну небольшую статью. Об алюминии лучше писать книги, ведь не зря же его называют "металлом будущего".
Строение и свойства атомов. Алюминий Аl - элемент главной подгруппы III группы (IIIA группы) 3-го периода Периодической системы Д. И. Менделеева.
Атом алюминия содержит на внешнем энергетическом уровне три электрона, которые он легко отдаёт при химических взаимодействиях. У родоначальника подгруппы и верхнего соседа алюминия - бора радиус атома меньше (у бора он равен 0,080 нм, у алюминия - 0,143 нм). Кроме того, у атома алюминия появляется один промежуточный восьмиэлектронный слой (2ё; 8ё; Зё), который препятствует притяжению внешних электронов к ядру. Поэтому у атомов алюминия восстановительные свойства выражены гораздо сильнее, чем у атомов бора, который проявляет неметаллические свойства.
Почти во всех своих соединениях алюминий имеет степень окисления +3.
Алюминий - простое вещество. Серебристо-белый лёгкий металл. Плавится при 660 °С. Очень пластичен, легко вытягивается в проволоку и прокатывается в фольгу толщиной до 0,01 мм. Обладает очень большой электрической проводимостью и теплопроводностью. Образует с другими металлами лёгкие и прочные сплавы.
Алюминий - очень активный металл. В ряду напряжений он находится сразу же после щелочных и щёлочноземельных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта очень прочной тонкой плёнкой оксида, которая защищает металл от воздействия с компонентами воздуха и воды.
Если порошок алюминия или тонкую алюминиевую фольгу сильно нагреть, то они воспламеняются и сгорают ослепительным пламенем:
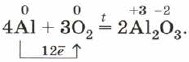
Эту реакцию вы наблюдаете при горении бенгальских огней и фейерверков.
Алюминий, как и все металлы, легко реагирует с неметаллами, особенно в порошкообразном состоянии. Для того чтобы началась реакция, необходимо первоначальное нагревание (за исключением реакций с галогенами - хлором и бромом), зато потом все реакции алюминия с неметаллами идут очень бурно и сопровождаются выделением большого количества теплоты:

Алюминий хорошо растворяется в разбавленных серной и соляной кислотах:

А вот концентрированные серная и азотная кислоты пассивируют алюминий, образуя на поверхности металла плотную, прочную оксидную плёнку, которая препятствует дальнейшему протеканию реакции. Поэтому эти кислоты перевозят в алюминиевых цистернах.
Как вы уже знаете, оксид и гидроксид алюминия обладают амфотерными свойствами. Алюминий растворяется в водных растворах щелочей, образуя соли - алюминаты, которые называют комплексными 1:
-
1 При взаимодействии гидроксида и оксида алюминия с растворами щелочей также образуются комплексные соли, например Na.
Алюминий широко используют в металлургии для получения металлов - хрома, марганца, ванадия, титана, циркония из их оксидов. Как вы помните, этот способ носит название алюминотермии. На практике часто применяют термит - смесь Fe3O 4 с порошком алюминия. Если эту смесь поджечь, например, с помощью магниевой ленты, то происходит энергичная реакция с выделением большого количества теплоты:
Выделяющейся теплоты вполне достаточно для полного расплавления образующегося железа, поэтому этот процесс используют для сварки стальных изделий.
Алюминий очень прочно связан в природных соединениях с кислородом и другими элементами, и выделить его из этих соединений химическими методами очень трудно. Алюминий можно получить электролизом - разложением расплава его оксида Аl 2 O 3 на составные части с помощью электрического тока. Но температура плавления оксида алюминия около 2050 °С, поэтому для проведения электролиза необходимы большие затраты энергии.
Технически доступным металлом алюминий стал после того, как в 1886 г. американский и французский учёные Ч. Холл и П. Эру установили, что оксид алюминия хорошо растворяется в расплавленном при 1000 °С криолите, формула которого Na 3 AlF 6 , с образованием электропроводного расплава. Расплав оксида алюминия в криолите подвергают электролизу в специальных установках (рис. 63) на алюминиевых заводах.

Рис. 63.
Схема электролизной установки для получения алюминия:
1 - электролит - расплавленный криолит с добавками фторидов кальция и алюминия (для снижения температуры плавления) и оксид алюминия (добавляют периодически); 2 - угольный катод; 3 - угольный анод; 4 - корка из застывшего оксида алюминия, защищающая расплавленный алюминий от окисления; 5 - стальная ванна; 6 - патрубок для отбора расплавленного алюминия
Мировое производство алюминия постоянно увеличивается. В настоящее время он оттеснил на третье и последующие места медь и другие цветные металлы и стал вторым по значению металлом продолжающегося железного века.
Алюминий почти втрое легче стали и устойчив к коррозии, поэтому выгоднее стали в тех областях применения, где требуются эти свойства (рис. 64).

Рис. 64.
Основные области применения алюминия и его сплавов
Соединения алюминия . В природе алюминий встречается только в виде соединений и по распространённости в земной коре занимает первое место среди металлов и третье - среди всех элементов (после кислорода и кремния). Общее содержание алюминия в земной коре составляет около 9% (по массе).
Укажем важнейшие природные соединения алюминия.
Алюмосиликаты. Эти соединения можно рассматривать как соли, образованные оксидами алюминия, кремния, щелочных и щёлочноземельных металлов. Они и составляют основную массу земной коры. В частности, алюмосиликаты входят в состав полевых шпатов - наиболее распространённых минералов и глин.
Боксит (рис. 65, а) - горная порода, из которой получают алюминий, содержит оксид алюминия Аl 2 O 3 .

Рис. 65.
Природные соединения алюминия:
а - боксит; б - корунд; в - рубин; г - сапфир
Корунд (рис. 65, б) - минерал состава Аl 2 O 3 , обладает очень высокой твёрдостью, его мелкозернистая разновидность, содержащая примеси, - наждак - применяется как абразивный (шлифовочный) материал.
Эту же формулу имеет и другое природное соединение - глинозём.
Хорошо известны прозрачные, окрашенные примесями кристаллы корунда: красные - рубины (рис. 65, в) и синие - сапфиры (рис. 65, г), которые используют как драгоценные камни. В настоящее время их получают искусственно и используют не только в ювелирном деле, но и для технических целей, например для изготовления деталей часов и других точных приборов. Кристаллы рубинов применяют в лазерах.
Оксид алюминия Аl 2 O 3 - белое вещество с очень высокой температурой плавления. Может быть получен разложением при нагревании соответствующего ему гидроксида алюминия:
Гидроксид алюминия Аl(OН) 3 выпадает в виде белого студенистого осадка при действии щелочей на растворы солей алюминия (рис. 66), например:
АlСl 3(изб) + 3NaOH = Аl(ОН) 3 ↓ + 3NaCl.

Рис. 66.
Получение гидроксида алюминия реакцией обмена из растворимой соли алюминия
Как амфотерный гидроксид, он легко растворяется в щелочах и кислотах (рис. 67):
Аl(ОН) 3 + NаОН (изб) = Na,
Аl(ОН)3 + 3HN03 = Al(NO 3) 3 + 3H 2 O.

Рис. 67.
Химические свойства гидроксида алюминия:
а - взаимодействие с щёлочью; б - взаимодействие с кислотой
Лабораторный опыт № 16
Получение гидроксида алюминия и исследование его свойств
Соли неустойчивых алюминиевых кислот - орто-алюминиевой Н 3 АlO 3 и метаалюминиевой НАlO 2 (её можно рассматривать как ортоалюминиевую кислоту, от молекулы которой отняли молекулу воды) - называют алюминатами. К природным алюминатам относится благородная шпинель (она украшает историческую реликвию - корону российских императоров) и драгоценный хризоберилл.
Соли алюминия, кроме фосфатов, хорошо растворимы в воде. Некоторые соли (сульфиды, сульфиты) разлагаются водой.
Хлорид алюминия АlСl 3 применяют в качестве катализатора в производстве очень многих органических веществ.
Открытие алюминия . Алюминий был впервые получен датским физиком X. Эрстедом в 1825 г. Название этого элемента происходит от латинского алюмен, так в древности назывались квасцы, которые использовали для крашения тканей.
Новые слова и понятия
- Строение атома алюминия.
- Физические и химические свойства алюминия: образование бромида, сульфида, карбида, оксида и алюминатов.
- Алюминотермия.
- Получение алюминия электролизом.
- Области применения алюминия.
- Природные соединения алюминия: алюмосиликаты (глина и полевые шпаты), корунд (рубин, сапфир, наждак).
- Амфотерность оксида и гидроксида алюминия.


